从海洋生物中分离出来的天然产物具有独特而多样的结构,其生物活性不同于来自陆生植物、真菌或微生物的天然产物,它们因为这些特点现在被广泛地当作创新药物骨架开发的重要来源。Zoanthamine Alkaliods是一类从海洋生物中分离出来的多碳环型复杂生物碱(图1),目前,该家族中最具代表性的天然产物是Norzoanthamine(2),它已经被发现具有很强的抗骨质疏松活性,可以明显抑制切除卵巢的小鼠的骨密度降低,有潜在的成药价值。在之前,有多个课题组曾经报道过Norzoanthamine的全合成,但都无外乎经历40余步,以及较低的产率。
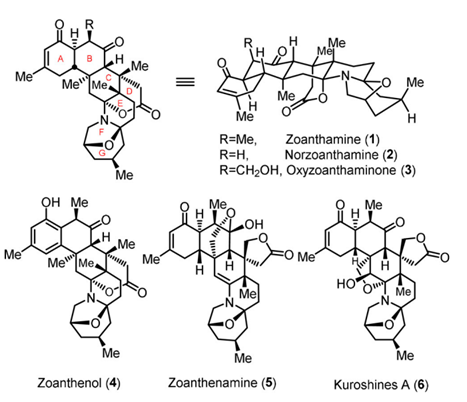
图1. Zoanthamine Alkaliods化合物家族的一些代表性结构
在对Norzoanthamine结构的分析中,该团队提出了几大合成挑战,这也是该结构中最具有代表性的部分:(1)复杂的七环骨架,并带有反式-反式-稠合的全氢菲A-B-C环;(2)十个立体中心,其中七个位于B和C环上的连续立体中心,其中还包括位于C-9,C-12和C-22位置的三个季碳中心;(3)具有两个酮结构,一个内酯和双氨基乙缩醛的密集官能化和高度氧化的骨架。经过逆合成分析,该团队将其分为5个片段(图2),并通过汇聚式合成策略,综合运用多种自由基环化反应,立体专一性地构筑反式[6.6.6]核心骨架,通过生源启发的环化反应,一步构建双缩酮胺结构,实现了复杂海洋天然产物norzoanthamine的不对称合成。相关工作发表在Angew. Chem. Int. Ed.上。
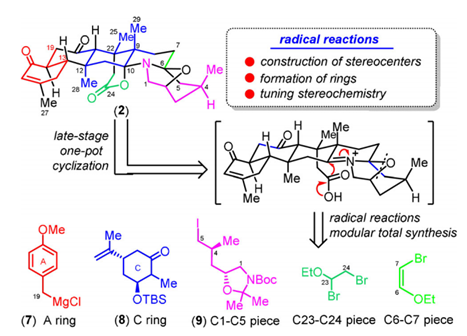
图2. 化合物Norzoanthamine的逆合成分析
首先,该团队进行了对C环(也就是片段20)的合成工作,片段20具有4个连续的手性中心和2个季碳中心。他们从易得的化合物8出发,在大位阻保护基OTBS的立体化学的控制下,通过羟醛缩合反应合成了10。随后,通过由Cu(BF4)2和Fe(BF4)2介导的臭氧化反应,一步消去异丙烯基得到了11。将11中的羟基用TES保护后,通过Baylis–Hillman反应再引入一个羟基。将12中新生成的羟基再次保护后,用MeLi亲核加成羰基,得到了含有叔醇中心的化合物13。用酸性较弱的PDC而不是PCC对化合物13进行了重排,合成含羰基化合物14,同时避免了底物13的保护基脱除。再将14中的TES保护基脱去后,和1、2-二溴-1-乙氧基乙烷发生亲核取代两步合成化合物15。15经由Ueno-Stork自由基环化反应,通过自由基重排制备得到了双环化合物18,该步骤是具有极高的立体专一性的。随后,通过Wittig反应引入双键,脱硅基反应等三步制备19a/b,但值得一提的是19b可以在酸性环境下异构化为19a,这也经过了X射线衍射的证实。最后,通过Dess-Martin氧化反应,合成了片段20(图3)。在这条合成路线中的每一步收率都控制在60%以上。
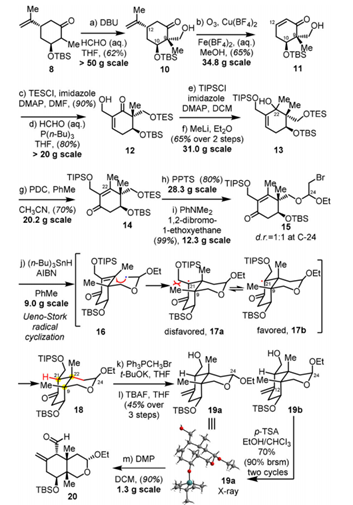
图3. 环C(片段20)的合成路线
成功合成20后,将其与已经准备好的格式试剂7反应并经过乙酰基保护,合成化合物21,该步骤有良好的立体选择性,C-20处的d.r.值大于20:1。化合物20经过Salen-Co催化的自由基氢转移反应,构筑了苯丙稠环,并且在C-12处构建出了季碳手性中心。随后通过Birch还原去芳环,再经乙酰基保护和水解反应制得含有四取代双键的化合物24。若想将24中的四取代双键还原,需要较强的还原剂,因此酮羰基也会被还原为羟基,所以在Mn介导的PhSiH3还原后,通过IBX氧化,一锅法制得酮类化合物25。25经区域选择性的去质子化后制得烯醇硅醚中间体,再经IBX•MPO氧化后,以两步70%的收率获得化合物26(图4)。
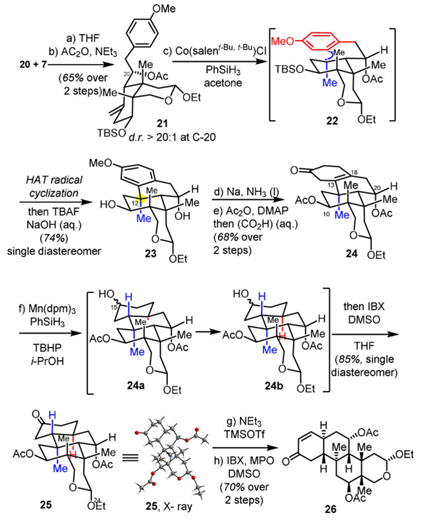
图4. 四环化合物26的合成步骤
为了合成具有双缩酮氨的结构,该团队先通过Co(Salen)催化不对称硝基醇反应合成了C-1至C-5片段9。在化合物26中已经构建好了稠环骨架和各手性中心,因此接下来团队将注意力集中在了侧链修饰和氧化态调控上。用樟脑磺酸(CSA)对C-24处的乙酰基进行水解后,在C-15上引入一个甲基,得到化合物27,再立即用氢化铝锂开环得到含有5个羟基的化合物28。用TIPSOTf/咪唑对C-29位的伯羟基进行选择性保护,再对未保护的C-8羟基进行选择性氧化。随后通过烯基锂试剂的加成及水解反应,实现化合物31的合成。再将化合物31与已经提前制备好的片段9偶连,再Ley氧化得到侧链修饰的化合物32。化合物32再通过金属催化剂四(三苯基膦)钯介导的区域选择性还原,得到长碳链结构的33。而后通过脱硅反应和 PCC氧化反应,实现不饱和酮化合物的合34的制备;再由Pinnick-Lindgren-Kraus氧化反应完成生源环化前体35的制备;最后通过生源启发的环化反应一步实现双缩酮胺结构的构筑,从而以33步反应和高于10%的收率实现Norzoanthamine的全合成(图5)。
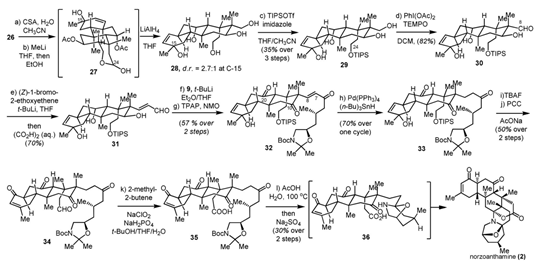
图5. 从化合物26至Norzoanthamine的全合成路线图
总而言之,基于模块化策略,该团队实现了具有较高生物活性的海洋生物碱Norzoanthamine的简明不对称全合成。团队创新性地将自由基环化反应用于合成具有挑战性的碳环核,将Ueno-Stork自由基环化用于在邻氨基苯乙胺的C-9和C-22位置构建邻近的四级立体中心。用来自市售材料(S)-(+)-香芹酮作为原来,该36步的合成录下你可以精确控制七个相邻立体中心的立体化学,并有效构建高度拥挤的七环骨架。由于十立体中心和高度密集的七环骨架在Zoanthamine族化合物中广泛存在,因此,这种模块化合成方法有希望为化学合成足够量的各类Zoanthamine族天然生物碱提供灵活而可靠的解决方案。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202102643
DOI:10.1002/anie.202102643






暂无评论
发表评论