众所周知,研究人员已经大量研究了酸性溶液中的析氢反应(2 H+ + 2e- → H2),并探索了氢吸附行为及其具体的结构。因此,通过将交换电流密度 (j0) 与H中间体吸附能有机结合起来,科学家构建了酸性析氢反应的活性火山图(详见前述科普)。基于该活性火山图,可以预测不同催化剂的活性趋势,并可以解释包括贵金属、过渡金属化合物、甚至是非金属电催化剂的高 HER 反应活性起源。[1]
因此,有关酸性析氢领域的催化剂设计及其机理,包括催化剂表面活性中心的识别、催化剂活性评估和预测和高活性催化剂的设计等,吸引了大量的关注。然而,在碱性析氢(2 H2O + 2 e- → H2 + 2 OH-)领域,目前仍存在大量的难题。[2]
此外,HER交换电流密度在碱性溶液中比在酸性溶液中低约两到三个数量级。尽管碱性析氢反应机理看似合理,但碱性 HER 的能量学和动力学研究仍在很大程度上存在挑战。
这些挑战主要包括:
1)HER 活性与 pH 是否存在关联;
2)氢吸附/结合能是否作为唯一的活性描述符,就像在酸性条件下的情况一样,能用活性火山图描述活性趋势;
3)额外的水解离能垒是否影响整体反应速率。
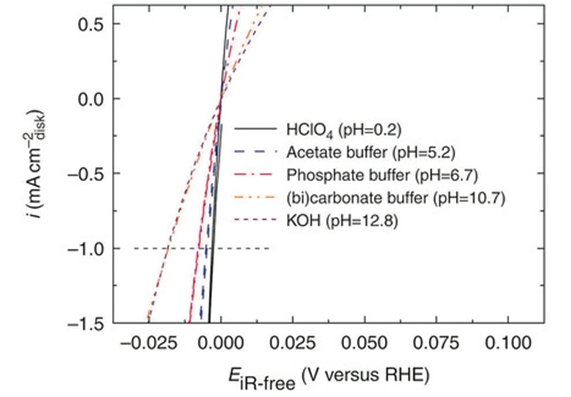
图1. 在不同 pH 值的 H2或 N2饱和电解质中的HER 极化曲线。(2)
pH的影响
尽管最新进展报道了许多高性能碱性 HER 电催化剂,但是其缓慢动力学的本征原因仍然存在争议,以及在碱性条件下的HER活性位点仍然没有定论。与酸性相比,这些问题本质上阻碍了碱性 HER 电催化剂的发展。与酸性溶液中的 HER一样,碱性HER也涉及 Volmer-Heyrovsky 或 Volmer-Tafel 步骤,只不过 Volmer 步骤之后的氢中间体 (H*) 是由初始水解离步骤 (H2O+ e-→H*+OH-)。这种水解离过程可能会引入额外的能量势垒,可能会控制整个反应速率。[3]
因此,单晶 Pt 电极的动力学参数(交换电流密度、Tafel 斜率和反应活化能)在碱性和酸性溶液中存在差异。反应速率主要归因于中间体的热力学状态和反应的动力学障碍。[4]实验观察表明,HER活性随着 pH 值的增加而逐渐降低(图1 )。[5]
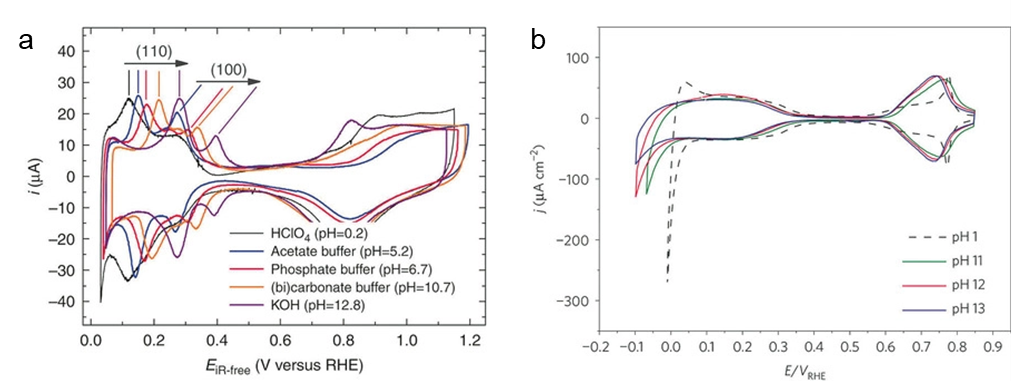
图2
(a) 多晶 Pt 电极在不同 pH 值的 H2或 N2饱和电解质中的HER 极化曲线。
(b) Pt(111) 在不同 pH 条件下的 CV 曲线比较。(3)
活性描述符
在HER 过程中,在不同电位区域下存在两种氢物种:氢的强吸附欠电位沉积 (Hupd),其存在于析氢/氧化过程 (HER/HOR) 的热力学可逆电位 (E0) 之上,以及氢的弱吸附过电位沉积 (Hopd),它存在于 E0 之下。虽然后者是直接控制 HER 速率的实际反应中间体,但前者在 HER 过程中也起着非常重要的作用。Hupd 的性质已在表面电化学实验中得到广泛研究,用于测量标准热力学状态函数,即吉布斯能量 (ΔG) 和焓 (ΔH)。而金属-Hupd 键 (DM-H) 强度,也已被用作酸性 HER 的活性描述符。
有两种不同的观点来解释这一重要现象:
1)与pH相关的 H 结合能 (HBE) 是活性差异的来源,因此 HBE 被认为是 HER/HOR 的唯一描述符(图2a)。如图所示,Pt 电极的 Hupd 区域中伏安峰的会随着 pH 变化而偏移,因此,该现象已被视为 pH 会影响 HBE 的直接证据。[6]然而,其分子水平的起源仍然难以捉摸。
2)在碱性条件下,HER 的表观活性受到水解离的限制,水解离会产生 H* 并且对 pH 敏感(图2b),因此需要考虑水解离的能垒。与此同时,越来越多的计算和实验研究证明,水解离能垒,在碱性析氢过程中占据了重要的地位。[7]
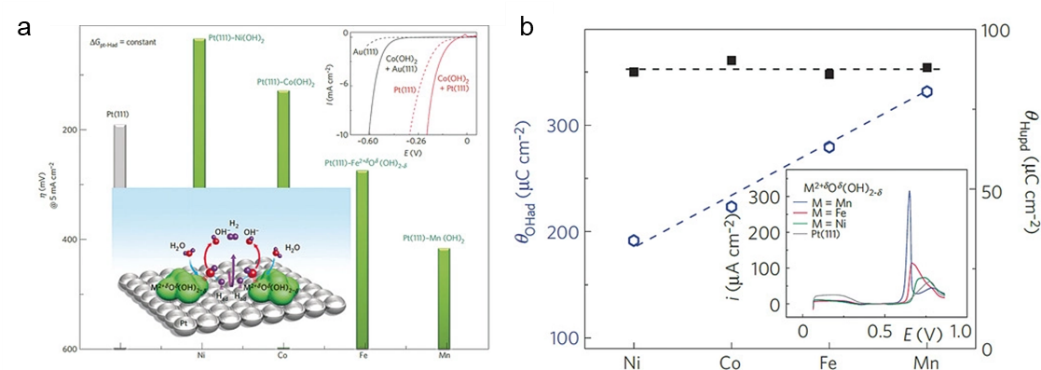
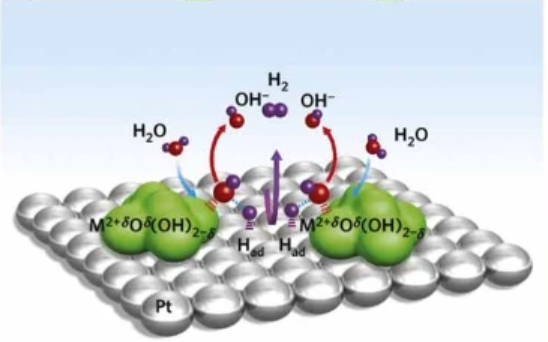
图3
a) 碱性 HER 过电位随 3d 过渡元素变化的趋势。插图:水解离、M-Had中间体的形成和两个 Had原子重组的示意图。
b) H* 和 OH* 电荷与 Pt(111) 上金属氧化物阳离子氧亲性的函数关系。
水解离过程
科学家进一步进行了系统研究,通过一系列精心设计的实验来揭示这种水解离的作用。[4]如图 3a 所示, 在 Pt(111) 与一系列具有不同亲氧性的 3 d金属氢氧化物复合后,每个复合体显示出相似的 H* 吸附能力,但计算得出他们具有不同的 OH* 吸附能力。这些复合材料的 HER 活性显示出类似火山的形状,并且可以观察到随着 OH-M 相互作用的弱化,活性会单调增加(图3b)。
因此,HER 的动力学既取决于在 Pt 底物上优化的 H* 吸附速率,也取决于 OH* 的解吸速率。换句话说,水解离过程快慢会影响整体反应动力学。这意味着必须在水解离的过渡态能量和 H*/OH* 的最终态能量之间找到平衡。例如,根据 BEP 原理,水离解的活化能垒越低,产生的 H*/OH* 吸附越强,这也可能导致水分子再吸附和氢重组所需的位点中毒。
结论与展望
根据研究人员的报道,对于前述提到的三个挑战/争议,已能大致总结出部分答案。首先, HER 活性与 pH 存在关联。HER活性随着 pH 值的增加而逐渐降低。对于其背后的原因,目前报道了两种结论,但仍存在争议。其次,氢吸附/结合不能作为唯一的活性描述符,因为水解离能垒/OH*脱附能也起着重要作用;额外的水解离能垒会极大地影响整体反应速率。
尽管在开发高性能碱性 HER 电催化剂方面取得了一些进展,但仍需要研究其活性来源的机理。为了应对这一挑战,接下来的研究方向可以从以下方面出发。首先,可以利用理论计算模拟连续变化的电极电位和电解质 pH 值下的反应。[8]此外,可以建立电催化剂的宏观活性和微观吸附能学之间的联系。从实验的角度来看,合成制备更理想的模型催化剂,以匹配理论计算中的催化剂至关重要。通过精确控制合成,设计缺陷较少的表面、晶体结构或晶面对于理论模型的构建非常重要。对于碱性 HER 电催化剂的设计原则,可以从氢吸附相对较强的表面入手,进一步削弱 HBE,是提高碱性 HER 活性的有效方法。对于水解离能力差的表面,促进水分解过程仍然是最佳的策略,尽管这会导致氢吸附增加,不利于产品解吸。






暂无评论
发表评论