原文链接:
https://doi.org/10.1021/jacsau.2c00105
研究背景
转录因子(TFs)在细胞功能和命运的确定中起着至关重要的作用。一系列上游信号汇聚在TFs上,通过特定的 DNA位点识别将重要的细胞信号转导过程转化为转录输出。因此,在人类基因组中的 1600个TFs中,与疾病表型相关的大于300个。TF功能障碍会导致一系列有害结果,包括癌症、糖尿病、自身免疫和心血管疾病。尽管有许多上游点可以间接调节 TF 功能,例如通过抑制激酶或共激活因子募集,通过针对失调信号通路的终点,直接和选择性TF拮抗是治疗这些疾病的一种特别引人注目的治疗途径。TF功能由蛋白质介导−蛋白质相互作用(PPI)和蛋白质−DNA相互作用,在大的表面上形成许多接触点。小分子(SMs)已被开发用于靶向相关DNA序列,但这些相互作用是非选择性的,且具有较低的特异性。此外,SM通常无法消除这些类型的相互作用,因为它们缺乏必要的相互作用热点,但如果肽可以设计为补充广泛的靶表面,则它们有可能成为高亲和力、选择性抑制剂。RCSB PDB中超过60%的多蛋白复合物具有螺旋PPI界面,其中至少20%参与基因控制。因此,尤其是基于螺旋的肽TF抑制剂,具有发展成为一类有用的转录调节剂的巨大潜力。在寻找具有功能活性的TF拮抗剂时,我们从基本的亮氨酸链(bZIP) DNA结合中获得灵感机制。该结构域的二聚化是由亮氨酸链(LZ)的形成驱动的,DNA结合结构域(DBD)向这些螺旋的N端延伸以促进DNA序列识别(图1 A)。我们在这里的工作重点关于开发抑制经过验证的致癌转录调节因子cJun分子,cJun是激活蛋白1家族的成员,通常是bZIP蛋白的典范。cJun与TREs结合,直接影响细胞过程,如分化、增殖和存活。因此,这些功能的失调会促进标志性癌细胞行为,使cJun成为用于癌症治疗的焦点。
存在许多合理的设计方法、文库筛选和选择系统,并已成功鉴定出能够与给定TF靶标结合的分子,但关键挑战仍然是确保靶标结合转化为功能消融。需要在这项工作中使用经过充分研究的目标样本进行选择,以提供合适的拮抗剂来验证分析概念。各种方法已经产生了靶向广泛的LZ结合界面的基于肽的cJun拮抗剂。然而,很难预测LZ结合是否会转化为功能性拮抗作用,因为cJun DBD仍然未结合本能够结合TRE DNA。一种合理设计的肽已被证明可以靶向cJun DBD,但其效力低于LZ拮抗剂,由于AP-1家族DBD之间的高度序列相似性,人们担心其特异性。同样,已经开发了一系列针对TRE DNA的 SMs,但它们的效力也较低,并且有可能产生脱靶效应,因为多个TF通常与任何给定的DNA元件结合,已知一些bZIP/DNA组合可以促进抗肿瘤结果。规避这些方法的潜在缺点的一种方法是利用更长的肽段,该肽段靶向完整的cJun bZIP结构域,具有选择性且高亲和力的相互作用,同时阻断DNA结合和LZ二聚化。Olive等采用这种方法生产A-Fos,它结合了野生型(WT) cFos LZ(已知与cJun异二聚化)和合理设计的Glurich酸性延伸(图 1B)。A-Fos设计原理假设LZ相互作用在N端延伸,通过将Leu残基掺入酸性延伸中的推定d位置促进DBD-酸性延伸相互作用。在这里,我们开发并验证了一种细胞内转录块存活(TBS)文库筛选试验,以寻找功能性TF拮抗剂,其中细胞存活仅在TF活性被消除时发生。此外,细菌生长速率与拮抗剂效率相关,从而允许TF拮抗剂之间的比较和竞争。我们使用肽库(131027个)展示了这种方法,证明它们可以被筛选在TBS平台内进行功能性cJun拮抗作用。选择的肽使用一系列生物物理方法进行验证,表明在靶结合和cJun/TRE DNA拮抗方面的亲本肽明显改善,这特别是通过降低同源二聚体稳定性来促进的。
文章亮点
1.作者报告了一种高通量、细胞内“转录阻滞存活”(TBS)筛选平台的开发,以衍生出功能性转录因子拮抗剂。
2. 作者研究发现在TBS中,同源TRE位点被引入必需基因二氢叶酸还原酶 (DHFR) 的编码区。cJun的引入导致TRE结合,通过直接阻断RNA聚合酶基因转录以消除细胞增殖来阻止DHFR表达。
3. 肽库筛选确定了一个序列,该序列通过防止DNA结合来结合cJun并拮抗功能,如恢复的细胞活力和随后的体外命中验证所证明。
4. TBS是一种完全无标签的基因型到表型的方法,可在复杂的细胞环境中选择理想的属性,例如高溶解度,靶标特异性和低毒性。
图文速读
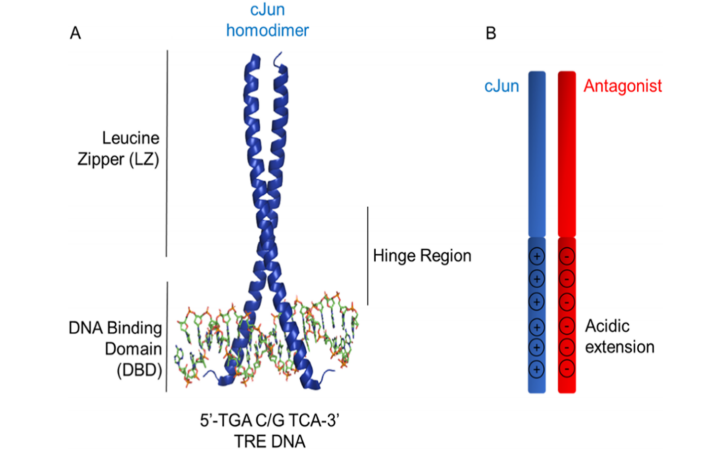
图 1. TRE DNA结合的cJun结构和cJun拮抗剂设计。(A)DNA结合的cJun同源二聚体晶体结构 (PDB: 2H7H)显示出突出了二聚化和DNA结合所需的LZ和DBD成分;(B)说明酸性扩展设计原理的示意图(A-FosW, HingeW),这利用了一个已知与cJun LZ结合的区域,在该区域上附加了一个富含Glu的扩展,以与cJun DBD交互。
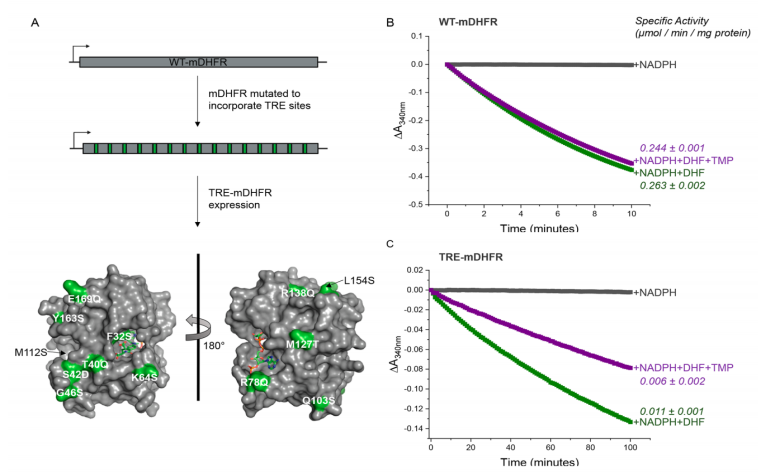
图2. mDHFR在引入TRE位点后保持活性。(A) 15个TRE位点被引入mDHFR基因(2个沉默和13个替换),以允许cJun诱导的转录阻断。在 mDHFR结构(PDB代码:1U72)上绘制了替换(绿色),表明在远离活性位点的位置有表面暴露,其中底物DHF(显示的是结合在DHF结合位点的竞争性抑制剂甲氨蝶呤(MTX))和辅因子NADPH绑定。测量340 nm处的吸光度变化以确定(B)WT-mDHFR和(C)TRE-mDHFR与或不与底物DHF的NADPH转换率。还显示了在TMP存在下重复的反应,表明两种酶的活性均保留,TRE-mDHFR如预期的那样被部分抑制。从线性初始速率(对于WT-mDHFR,前2.5分钟,对于TRE-mDHFR,前10分钟; 仅减去NADPH反应空白)计算比活性。MTX表现出比TMP更广泛的抑制作用,抑制真核和原核DHFR酶,因此抑制WT-和TRE-mDHFR(图S5)。
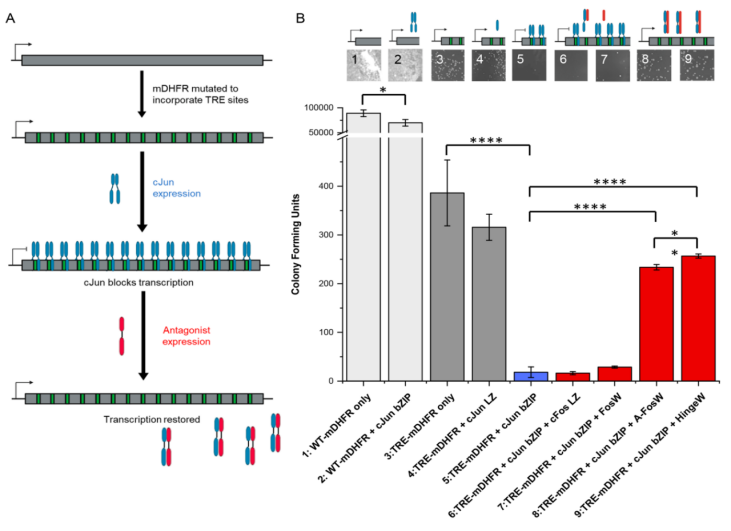
图 3. 转录块存活(TBS)测定以得出具有功能活性的cJun抑制剂。(A)说明TBS设计和操作的示意图;(B)将表达所示蛋白质的大肠杆菌数量控制在选择性培养基上,并通过计数菌落形成单位计算生长速率。(1)WT-mDHFR表达可以替代ecDHFR并且不受TMP 抑制,产生显着增长;(2)当cJun bZIP被额外表达时,观察到对菌落数的小影响;(3)TRE-mDHFR可以取代抑制的ecDHFR,其菌落计数低于预期的WT;(4)cJun LZ结构域(缺少DBD)不影响TRE-mDHFR转录和集落形成;(5)cJun bZIP结构域(带有 DBD)结合TRE位点以阻断TRE-mDHFR的转录,导致细菌存活率降低;(6)cFos LZ和(7)FosW是已知的cJun结合剂,但它们不能有效地将cJun bZIP与TRE DNA分离;(8)A-FosW和TBS衍生的命中;(9)HingeW去除TRE-mDHFR转录块以恢复细胞存活。

图4. 目标和拮抗肽序列和TBS文库设计。显示cJun靶序列并与相关的脱靶cFos进行比较。为了促进cJun结合的优化,选择A-FosW序列中10个残基区域(e4-g5)内的9个残基用于文库内的变异,提供酸性、极性和疏水性选项,从而形成一个131072个成员的文库使用TBS筛选产生“HingeW”序列。DBD和酸性延伸区域分别以蓝色或红色显示,胜者肽中选定的库选项以绿色突出显示。残基根据给定七元重复序列中的七元编号和位置命名。
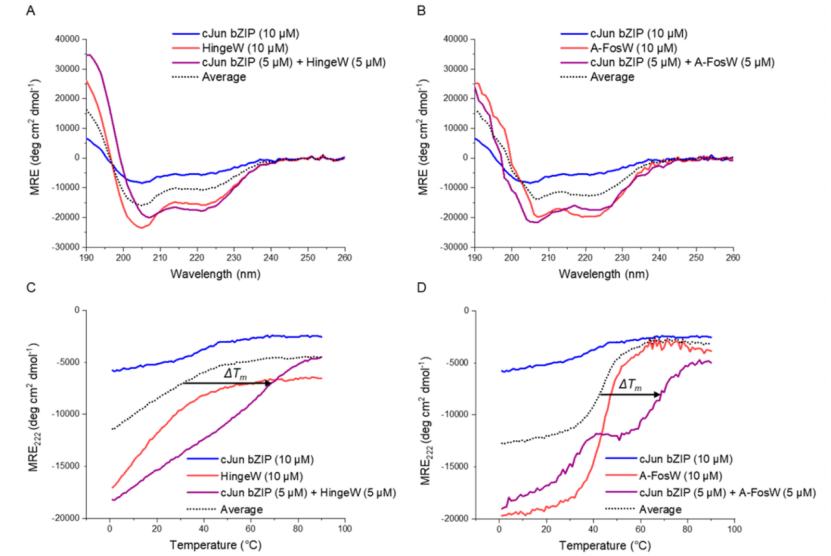
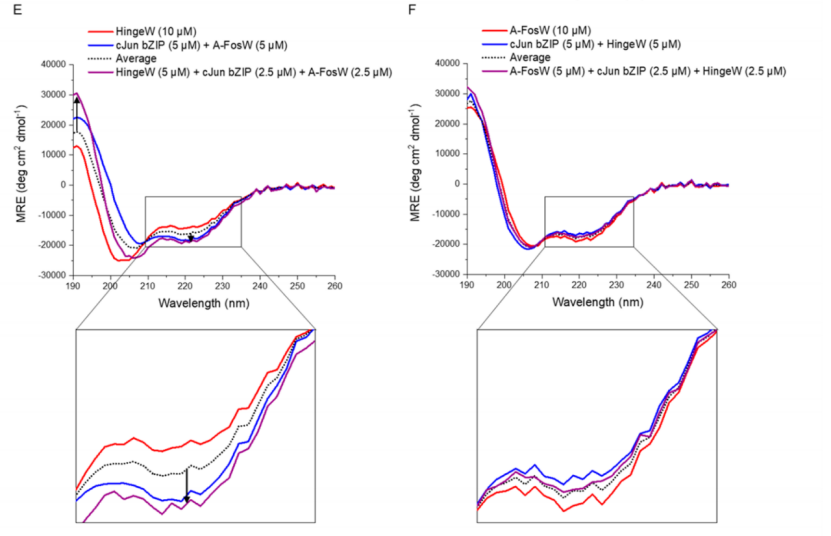
图 5. TBS胜出肽HingeW优先结合cJun而不是A-FosW。CD光谱(20 °C)显示cJun与(A)HingeW或(B)A-FosW的结合;在这两种情况下,异二聚体谱显示出相对于组分肽的平均值增加的α-螺旋特征(没有相互作用的预期谱)。然而,HingeW的影响更大,表明肽螺旋度的增加更大;类似地,与(C) HingeW或(D)A-FosW结合的cJun的热变性从组分肽变性曲线的平均值右移。由于HingeW同源二聚体的Tm较低(箭头所示),HingeW/cJun显示出比A-FosW/cJun更大的结合 ΔTm;CD二聚体交换光谱显示(E)当HingeW与A-FosW/cJun异二聚体混合时螺旋度增加,因为由于cJun对HingeW的结合偏好,HingeW与A-FosW交换;((F)当A-FosW与HingeW/cJun异二聚体混合时,没有观察到平均值的变化,表明二聚体种群没有变化。显示的箭头突出了190和222 nm处平均值的偏移。在所有实验中,总样品肽浓度固定为10 μM,使用等摩尔浓度的每个组分肽来消除浓度依赖性影响。
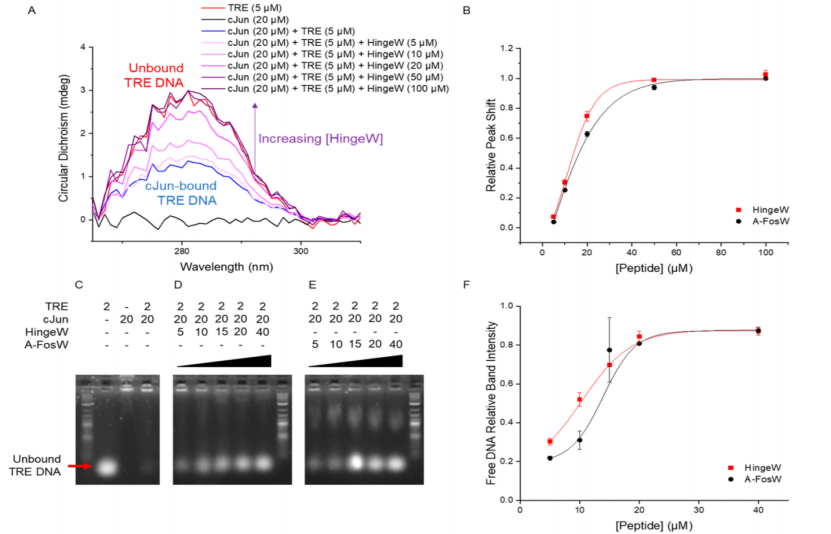
图 6. HingeW比A-FosW更有效地拮抗cJun/TRE DNA相互作用。(A)CD光谱显示加入cJun后TRE DNA峰在281nm处发生变化,这被HingeW滴定到样品中而逆转,因为HingeW将cJun隔离在非功能性异二聚体中;(B)对于不同浓度的HingeW和A-FosW,绘制了从结合 TRE到游离TRE的相对峰值偏移,显示出在所有浓度下HingeW对cJun/TRE DNA的抑制作用更大;EMSA 显示在添加cJun后(C)未结合的TRE DNA条带移动,随后在滴定(D)HingeW或(E)A-FosW后恢复未结合的DNA条带强度;(F)对于CD和EMSA,数据取自三个独立实验的平均值,绘制的误差条表示一个标准偏差。
总结展望
有许多筛选平台可以推导高亲和力PPI,但没有一个平台能保证靶点结合会导致靶蛋白功能丧失。以cJun/TRE为例,我们开发了一种转录块存活测定法,该测定法有可能用作推导能够消除 TF 活性的肽的通用方法。我们在细菌系统中设计了一个“分子刻度盘”,从而使cJun/TRE DNA相互作用与细胞增殖成反比。通过将cJun/TRE拮抗剂引入该系统,细胞生长成为拮抗剂功能性阻断众多cJun/TRE 相互作用的能力的直接读数,从而使分子拨盘上升。最有效的合理设计的酸性拮抗剂接下来被用作亲本序列来设计一个半随机文库,该文库在TBS平台上成功筛选,生产出经体外验证的HingeW。
建立TBS系统需要产生突变的DHFR基因(TRE-mDHFR),该基因在将15个TRE位点引入其DNA序列后保持其酶活性,从而导致13个氨基酸取代。当TF与TRE-mDHFR质粒DNA上的TRE位点结合时,这允许cJun诱导的转录阻滞。为了使TRE-mDHFR活性丧失,绝对需要mDHFR基因内的TF DBD和TRE位点,这证实了TBS系统的特异性。细菌生长速率的表型与通过系统在单个细胞中的容纳而表达的拮抗剂序列的基因型直接相关。细菌细胞由于其快速的生长速度,耐用性,易用性和低成本而非常适合此过程。至关重要的是,它们还允许在没有任何可能干扰测定的相关真核TF的情况下直接测量cJun与TRE位点的相互作用。需要做更多的工作来验证TBS分析命中可以转化为哺乳动物系统;但是,主要障碍是定义抑制剂。旨在使这些肽与哺乳动物系统兼容的进一步修饰将是抑制剂开发的下一步,尽管此处使用的细胞内选择模式应有利于这一点。此外,许多体外筛选系统已在药物开发管道中被广泛采用,噬菌体展示方法以及相关的mRNA和核糖体展示筛选系统的广泛使用证明了这一点。
TBS促进了高通量基因型到表型的筛选和肽库的竞争,以从那些结合但对靶活性几乎没有或没有影响的那些(或那些根本没有结合的那些)中分离出那些导致cJun DNA结合活性功能丧失的那些。这种区别很重要,因为这意味着拮抗剂不仅必须与溶液中游离的靶标结合,而且还必须能够满足将TF从DNA中解放出来的要求更高的任务,而已知DNA更稳定。最后,以上所有工作都是在细胞质的复杂环境中进行的,在初始筛选阶段将有毒、非特异性、不溶性或蛋白酶敏感的分子排除在外,而不是在后期的命中验证或临床试验阶段确定这一点。这些因素对于较长的肽特别重要,例如那些与大而浅的cJun bZIP表面结合所需的肽,这些肽往往缺乏这些重要的品质。TBS通过完全消除对庞大的蛋白质融合物或疏水/芳香标签的任何要求,改善了相关的蛋白质片段互补测定以及体外筛选平台 (例如噬菌体展示或核糖体展示),这可能会干扰相关测定相互作用并导致错误读数。
TBS的主要优势是需要检测命中以防止TF与其共有DNA序列结合,例如A-FosW的组合设计,这是一种包含A-Fos32和FosW PCA命中的域的混合体。在A-FosW,LZ以高亲和力和选择性靶向cJun bZIP的拮抗剂,添加的酸性延伸有助于通过阻断cJucJun/TRE DNA相互作用。bZIP蛋白的LZ结构域倾向于显示比DBD更多的序列多样性,这对于特定AP-1家族成员的治疗靶向很有用,提供更好的控制和可能更少的副作用。虽然不清楚A-FosW它是否按设计通过形成单个连续LZ相互作用来结合cJun,预计cJun铰链区周围增加的结合会传播增加的螺旋度,因此在任一方向上都可以传播。此外,Olive等人的原始工作支持关注铰链区,其中A-Fos的该区域(A-FosW的a4位上的N26L)中的点突变导致cJun结合亲和力和随后的显着增加cJun/TRE拮抗作用。通过合理设计优化酸性扩展受到缺乏指导的设计规则的阻碍,就像LZ域的情况一样,它具有已知的结构和预测工具来产生高亲和力相互作用。此外,以前没有使用基于库的方法来优化cJun的该区域内的绑定。使用 AFosW作为设计模板并在铰链区包含库选项是明确的下一步,这导致了HingeW的TBS选择,目标cJun蛋白的亲和力为14nM(比A-FosW提高6倍)。HingeW比A-FosW包含更多的酸性残留物,支持Olive等人。方法在整个N端域中包含显性负电荷,以与cJun DBD内的正电荷有利地相互作用。然而,与简单地产生带负电荷的残基块相比,精确的选择模式更加细致入微。HingeW的性质表明TBS文库筛选方法的另一个好处,其中拮抗剂的定向进化通过减少同源二聚化而导致改进。TBS通过产生蛋白质序列在探索新序列空间方面提供了相当大的效用,如果不使用这种文库筛选方法,这是无法预测的。
TBS在半理性PPI设计中开启了一项新功能,其中affinity和活动是共同选择的。这为将TBS方法扩展到新库和目标提供了巨大的潜力,以前的工作可能产生了潜在的拮抗剂,后来发现这些拮抗剂缺乏功能活性。原则上,该方法可以完全扩展到识别离散共有序列的任何DNA结合蛋白,甚至是任何附加了DBD的二聚体系统。该方法可以被认为是可推广的,因为任何DNA共有序列都可以并入DHFRDNA序列中,并且可以通过相关TF的共表达来进行转录阻断。这将需要对DHFR设计过程进行迭代,并对每个系统进行后续测试和优化。然而,这里的中心原则已被证明是有效的。它还可能允许筛选外源分子以允许同时分析细胞渗透剂和功能活性抑制剂。此外,具有不同设计原则和扩展选项的文库在产生涉及致病性TF的广泛靶标的肽命中方面具有相当大的额外前景。使用标准技术和现成的试剂,106-107的文库大小是可能的,这可能允许开发更广泛的肽多样性并进一步优化。对一系列TF靶点的进一步TBS筛选将产生非遗传工具和疾病途径的探针,但新一代优化的功能拮抗剂和临床线索也具有相当大的潜力。








暂无评论
发表评论