文章亮点
1.通过原位合成L-酪氨酸功能化共价有机框架(L-Tyr-COF)来填充纳米通道膜。L-Tyr-COF填充使纳米通道膜的孔径减小,与萘普生对映体(S/R-NPX)相匹配,并提高了对映选择性。
2.与L-Tyr表面功能化的纳米通道相比,L-Tyr-COF填充的纳米通道对S-NPX表现出很高的对映选择性,实现了对映体的分离,对映体过量值高达94.2%。
3.该研究提供了一种尺寸匹配策略和手性共价有机框架填充纳米通道膜,实现了高选择性和高通量的对映体分离。
背景介绍
对映异构体药物的生物行为和毒性差异很大,因此对映异构体的分离是十分必要的。面对日益增长的手性药物需求,需要具有高选择性和高通量的对映体分离方法。与色谱法相比,纳米通道膜分离法具有处理量大、连续操作、效率高等优点,显示出手性药物分离的巨大前景。
目前,大多数纳米通道膜是通过用单层手性分子,如氨基酸和环糊精修饰纳米通道的表面来制备的。手性分子功能化的策略实现了对映体的识别,但很难实现对映体的控制运输和分离。原因之一是表面上的单层分子很难控制分布在纳米通道大空间中的所有对映体。面对对映体分离的需求,在高通量的基础上实现高选择性是纳米通道膜的主要挑战。
研究人员已经意识到,纳米通道的孔径是提高对映选择性控制运输的一个关键问题。在生物系统中,控制药物运输的蛋白质通道的直径约为3 nm。纳米多孔框架被用来构建选择性运输的人工通道,如共价有机框架(COF),金属有机框架(MOF),以及逐层组装材料。COF具有可调节和一致的孔径大小,与药物烯烃的分子大小相匹配。统一的孔径大小,与药物对映体的分子大小相匹配,并且比MOF或逐层组装有更稳定的结构。目前,有几个复合纳米通道膜是通过在膜表面涂上一层手性COF来制造的。这些报道显示了比那些由单层手性COF修饰的纳米通道膜具有更好的对映选择性。同时说明控制COF尺寸在提高选择性方面的重要性。
图文速读
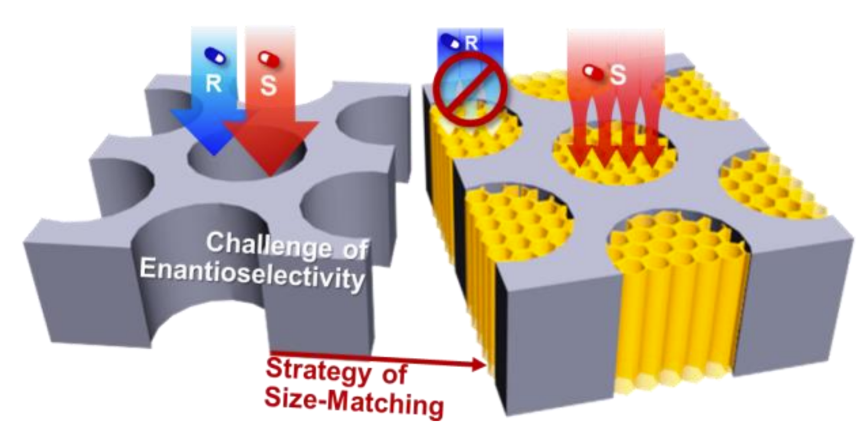
方案1. 设计手性COF填充纳米通道膜以解决对映选择性分离的挑战。
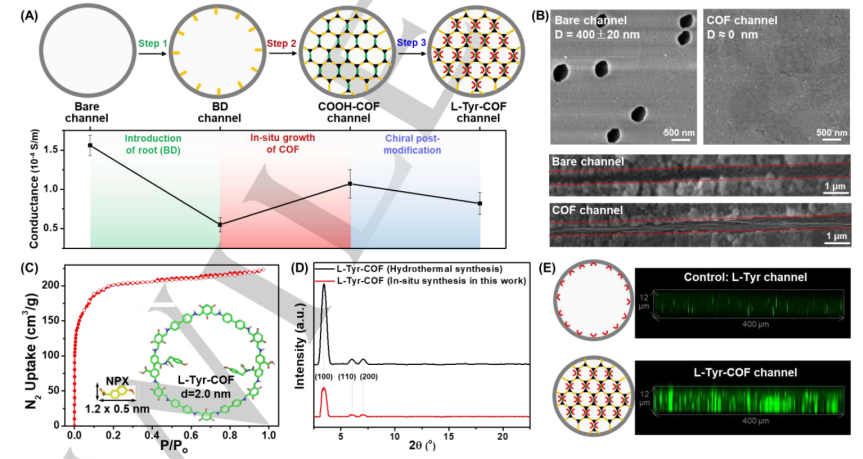
图1
(A)L-Tyr-COF填充纳米通道的制备过程。插图:空白通道、BD通道、COOH-COF通道和L-Tyr-COF通道的电导率(电解质:0.1M,pH=7,PBS缓冲溶液);
(B)原位合成L-Tyr-COF纳米通道前后的SEM图像;
(C)原位合成的L-Tyr-COF的N2吸附/解吸等温线。插图:萘普生的分子大小和L-Tyr-COF的孔径大小;
(D)水热合成的L-Tyr-COF粉末和原位合成的L-Tyr-COF的XRD图;
(E)L-Tyr通道和L-Tyr-COF通道的荧光共聚焦图像。
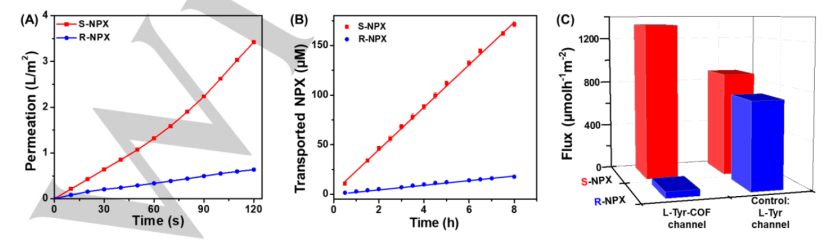
图2
(A)S/R-NPX通过L-Tyr-COF通道的选择性渗透;
(B)S/R-NPX通过L-Tyr-COF通道的选择性运输;
(C)S/R-NPX通过L-Tyr-COF通道的运输通量(对比:L-Tyr通道)。
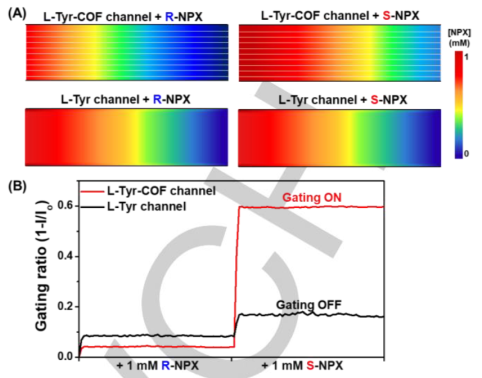
图3
(A)S-NPX和R-NPX的L-Tyr-COF通道的门控比和
(B)浓度分布(对比:L-Tyr通道)。
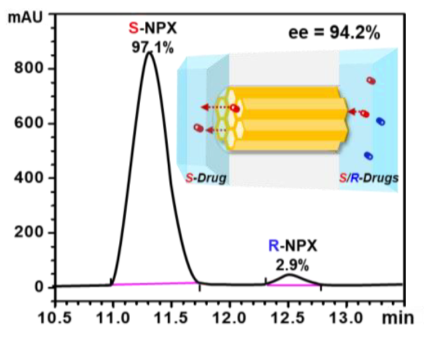
图4 通过L-Tyr-COF通道膜分离萘普生的HPLC图。
结论与展望
在这项工作中,作者通过原位合成L-酪氨酸功能化共价有机框架(L-Tyr-COF)来填充纳米通道膜。L-Tyr-COF减小了纳米通道的孔径,使之与药物对映体的分子大小相匹配。与表面功能化的L-Tyr纳米通道膜相比,通过L-Tyr-COF包装的纳米通道膜在控制运输和对映体分离方面的选择性增强了20倍。这种手性COF填料纳米通道膜实现了萘普生的对映体分离,具有很高的对映体选择性(ee=94.2 %)和高通量(1.33 mmol m-2 h-1)。与其他报道的策略相比,引入尺寸匹配和多孔的COF不仅提高了选择性,而且还确保了高通量。手性COF填料纳米通道膜具有对映选择性、通量、通用性和可回收性等优点,有望应用于高选择性和高通量的对映分离。






暂无评论
发表评论