寻找新元素并探究其性质,是社会发展的必然途径,也是科学发展史中最具探查性的领域之一。人类对元素持之以恒的坚持与追寻,造就了现代世界。其中磷元素的发现极具传奇色彩,下面让我们一同追随化学家探险的足迹,破解磷元素的奥秘。

磷的发现
古老的东方,皇帝为追求长身不老,涌现大量道士进行炼丹之术。在西方16世纪时期,人们同样为了追求长生之术,炼金师这一身份随之也迎面而来。他们认为“金”,是太阳的眼泪,是精神的支持,是权力的象征,是长生的灵药。虽然此时炼金师还不知道元素的存在,但却已经懂得如何利用碱金属提炼金。正是因为对金的迷恋,为探索元素之旅迈出了突破性的第一步。
在长生之术的追求过程中,炼金师何尼格•波兰特认为,人作为宇宙的缩影,那么金会不会隐藏在人体内呢?带着这一猜想,波兰特着手进行了他的实验探索。他认为尿液跟金有着相同的颜色,则金可能隐藏在人体尿液中。1669年,波兰特在他的实验室中,进行了一项他认为是非常伟大的实验操作,即用尿提取金[1](图1)。第一步,他将50桶尿液进行加热煮沸,去掉尿液中多余的成分水;第二步,将得到的提取物进行蒸馏直至糊状;最后,在高温条件下对其糊状物持续加热至两到三天。在加热过程中,一缕一缕的白烟相继产生,并在空气中自发燃烧。可这种自燃的物质到底是什么呢?它并没有太阳般的金色,但其燃烧时,却有着太阳般耀眼的光亮,并且在燃烧的过程中,由于吸收热量,使容器瓶发冷,因此波兰特将其称之为,寒冷的夜光。

图1.波兰特实验(图源自网络)
波兰特虽然没有从尿液中提取出金,但却发现了一种新的元素——可自燃的磷。可对于一心只想得到金的波兰特来说,这一现象完全没有引起他的重视,于是他以较低的价钱卖了这个秘密。不久磷便在欧洲宫廷中受到大力追捧。
1677年,磷被传送到查尔斯二世的宫廷中,同样是炼金师的罗伯特•波义耳在目睹这一发光物质后,对其进行了深入研究。后人在波义耳的书中,节选到《关于寒冷的夜光的新实验和观察》这一文章,其中记载了关于磷的具体实验操作:取半粒干燥的磷和6倍重的硫粉,放在折好的纸片中并用刀柄进行摩擦,磷燃烧了(图2)。后来,这一实验不仅被誉为制造火柴的前驱体,同时还催生了一个庞大的工业,迅速促进社会发展。

图2.波义耳实验(图源自网络)
磷的发现使一位炼金师变成了第一位伟大的现代化学家,并为未来新元素的发现奠定基础,使炼金术远离阴暗,进入一个开明、理性的时期。
直至1796年,随着元素这一概念的诞生与发展,拉瓦锡才真正认识到波兰特所提取的发光物质其实也是一种元素,于是根据波兰特的名称将其命名为磷(P),自此正式成为元素家族中的一员[2](图3)。
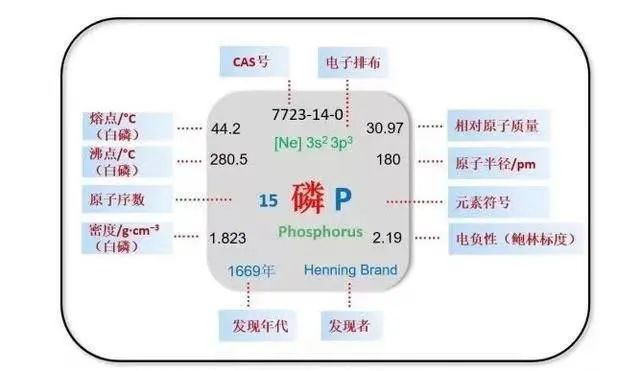
图3.磷的性质(图源自网络)
多变的磷
波兰特首次发现可自燃的磷属于白磷,但随着对化学的不断探究,我们知道原子排列方式不同,构成物质不同,其性质也完全不同,在化学家族中将其称之为同素异形体。磷的同素异形体主要包括:白磷、红磷、黑磷(图4)。

图4.白磷,红磷,黑磷(图源自网络)
白磷,又称之为黄磷,化学式为P4,正四面体结构,是一种浅黄色半透明态固体,于黑暗中能发光,有臭味,有毒。白磷活泼性强,熔点约为44℃,在室温下就可以与空气中的氧气发生反应,引发“自燃”。
1845年,奥地利化学家施勒特尔发现了磷的第二种同素异形体——红磷,又称之为赤磷,是一种鲜红色粉末状物质,化学式一般直接写为P。红磷中磷原子排列为链状,相较于白磷更加稳定,其熔点约为300℃,无毒。于是,人们通常用红磷取代白磷制作更为安全的火柴。
黑磷是白磷和红磷在高温高压条件下转化生成的另一种同素异形体,又称之为金属磷,在磷的同素异形体中反应活性最弱,化学性质最稳定。虽然磷属于非金属元素,但由于黑磷的结构式类似于石墨,因此可以导电,用于半导体材料的制作。
磷的应用
(一)磷在农产业中的应用
在农产业中,磷、氮、钾被称为是肥料三要素,直接参与农作物光合作用、呼吸作用、细胞分裂过程。对于农作物的生长磷具有一定的促进作用,可增强其根系发育、成熟速率,还可增色增味,提高产物品质。此外,磷对于农作物的抗旱、抗寒、抗倒伏能力具有一定的帮扶作用,并降低其虫害机率、减少落花落果数量,提高农作物生产率。
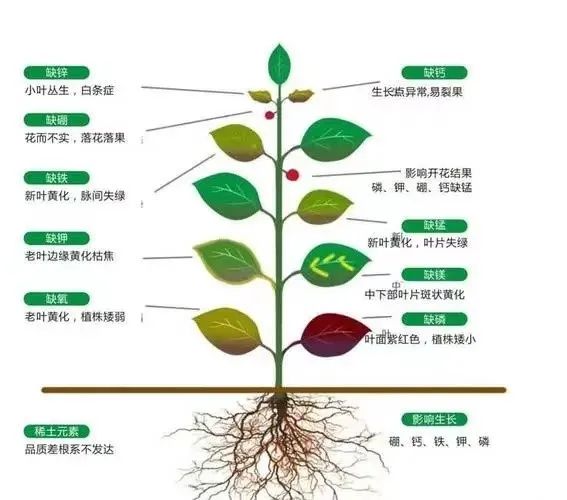
图5.磷对农产业的作用(图源自网络)
但土壤中的磷主要是以螯合态的形式存在,不易被植物吸收。如若过量使用,还会造成一定的产业弊端,导致农业面源污染,土壤板结、水体富营养化等现象,所以为了生态环境,科学指导施肥是防止污染的有效措施。随着科技的发展,为了从源头进行污染管理,科学家利用解磷微生物制作生物肥料,这种肥料可以将土壤中难以吸收的磷转化为能够被农作物主动吸收的可溶性磷,不仅对生态环境起到保护作用,还提高了磷的利用率[3]。
(二)磷在生物学中的应用
P与C、H、O、N、S等非金属元素共同被称为是生命组成中必不可少的常量元素。人体内,磷大约占体重的百分之一,其中百分之八十与钙结合,以磷酸钙的形式储存在我们坚硬的骨骼和牙齿中,除此之外在DNA序列,血液及人体其他组织中也都含有磷元素[2]。
而体内多余的磷元素将以尿液的形式排除体外,且正常每升尿中磷含量小于1克。在医学中,磷对其载药性、抗菌活性及神经再生等功能方面具有一定的医疗效应[4]。例如含磷合成药物可促进骨骼增长,治疗骨质疏松症等疾病。同时由于黑磷层内原子之间较强的共价键及层与层之间较弱的范德华力,使得黑磷很容易被剥离为单层或超薄的纳米片,根据这一性质,现阶段随着纳米技术的发展,新兴的黑磷纳米材料也在生物医学领域中被广泛应用,根据其出色的光学吸收能力、高效的药物负载率、良好的生物相容性及无毒的生物降解性等功能,为口腔医学、脑靶向药物的运输创造了新的平台[5-6]。
然而与其他五种元素相比,磷在地球上的储存量并不是十分丰富,美国化学学会(ACS)所列举的元素稀缺程度周期表中,磷是唯一具有短缺风险的生命必需元素[7](图6)。
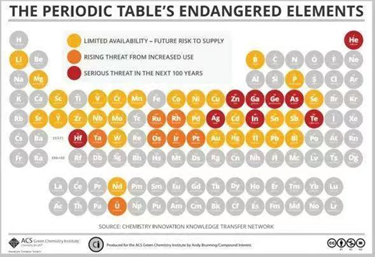
图6.元素稀缺表(图源自网络)
(三)磷在工业中的应用
在工业生产中, 磷及其化合物也有着非常重要的应用价值。白磷可用于制备高纯度的磷酸(H3PO4),用于工业助焊剂、分散剂、防腐剂等,制备三聚磷酸钠(俗称“五钠”)用于肥皂增效剂、水处理剂,以及制备次磷酸钠(NaH2PO2)作为抗氧化剂用于化学镀镍等等。红磷可作为钠离子电池负极材料,借助其极高的理论比容量、合适的氧化还原电位及丰富的资源储量,大幅度提升钠离子电池能量密度,是极具潜力的钠离子电池负极材料[8]。其中将其纳米化是作为制备红磷负极材料的关键环节,是缩短钠离子传输路径、改善红磷倍率性能,减小红磷体积效应、实现长期循环稳定的重要手段,目前纳米红磷的制备方法主要包括球磨、升华冷凝、热还原、气相生长、溶剂热、化学沉淀等[8]。
除此之外,磷在电子、食品等行业也同样有着广泛的应用。虽然,磷的发现带来诸多益处,但其实磷也有黑暗的一面。早在二战时期,投放到汉堡的数千颗炸弹中都含有磷,而可悲的是波兰特就是在汉堡发现了磷。
总结
现今,磷已融入我们生活的方方面面,在农业、工业、生命科学等领域内,都发挥着无可替代的重要作用。磷,虽然可以造福人类,但也可以毁灭家园,到底何去何从,其实并不取决于磷,而是取决于人类。投身于科学事业的伟大工作者,历经千辛万苦,凭借不懈努力将月亮之光带给人类,希望都可将其应用于光辉事业中,造福人类。









暂无评论
发表评论