1背景介绍
金属-有机骨架材料(MOFs)是近二十年来发展迅速的一种配位聚合物,具有三维的孔结构,通常以金属离子为连接点,有机配位体为支撑构成空间3D延伸,MOF是沸石和碳纳米管之外的又一类重要的新型多孔材料。MOF具有它具有高孔隙率、低密度、大比表面积、孔道规则、孔径可调以及拓扑结构多样性和可裁剪性等优点,被广泛应用于气体吸附、离子交换、多相催化等领域。
2文献分析
1、超高速醇水分离的高柔韧性超疏水MOF纳米片膜
第一作者:徐李昊、李申辉
通讯作者:赵之平、冯英楠
论文链接:
https://www.science.org/doi/10.1126/science.abo5680
发表日期:2022年10月20日

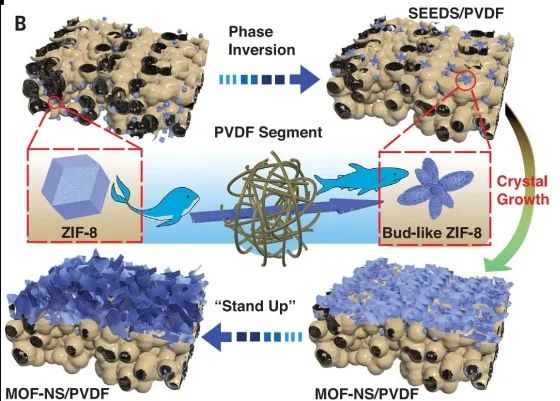
图1. MOF-NS/PVDF膜的制备工艺和结构
作为一种节能的分离技术,膜分离过程因其减少碳排放和减少污染的需求而备受关注。从发酵液中回收酒精等生物燃料对于提高产量至关重要,疏水聚合物膜被广泛应用于渗透汽化回收生物乙醇。然而,聚合物基渗透汽化膜的分离性能通常受到相对较低的渗透率或选择性以及渗透性和选择性之间的平衡的限制,这限制了其进一步应用。因此,开发一种高性能渗透汽化膜的策略有助于降低能耗并提高工业生物燃料生产的效率。MOF因其特殊的吸附亲和力、高的可设计性以及多样化的孔结构和大小而被广泛研究。高孔隙率的MOF已被嵌入到聚合物基质中以制备混合基质膜。
在此,研究者报道了一种具有良好柔韧性和渗透选择性能的MOF-NS膜的策略。MOF-NS膜具有蜂窝状结构,具有大的比表面积、高的粗糙度和快速的分子传输通道。聚二甲基硅氧烷(PDMS)包覆后,制得的无缺陷超疏水膜在乙醇-水分离中表现出超快渗透汽化性能。分子模拟证实了其结构,并揭示了其运输机制。MOF-NS中的超快传输通道在40 ℃下对5% 乙醇-水的渗透汽化表现出超高的通量和8.9的分离因子,可用于生物燃料的回收。MOF-NS和聚二甲基硅氧烷对分离性能有协同作用,该研究为进一步的应用提供了理论依据和支撑。
2、MOF助力人工光合作用

第一作者:蓝光旭、范英杰、史文颉
通讯作者:林文斌
论文链接:
https://www.nature.com/articles/s41929-022-00865-5
发表日期:2022年11月10日
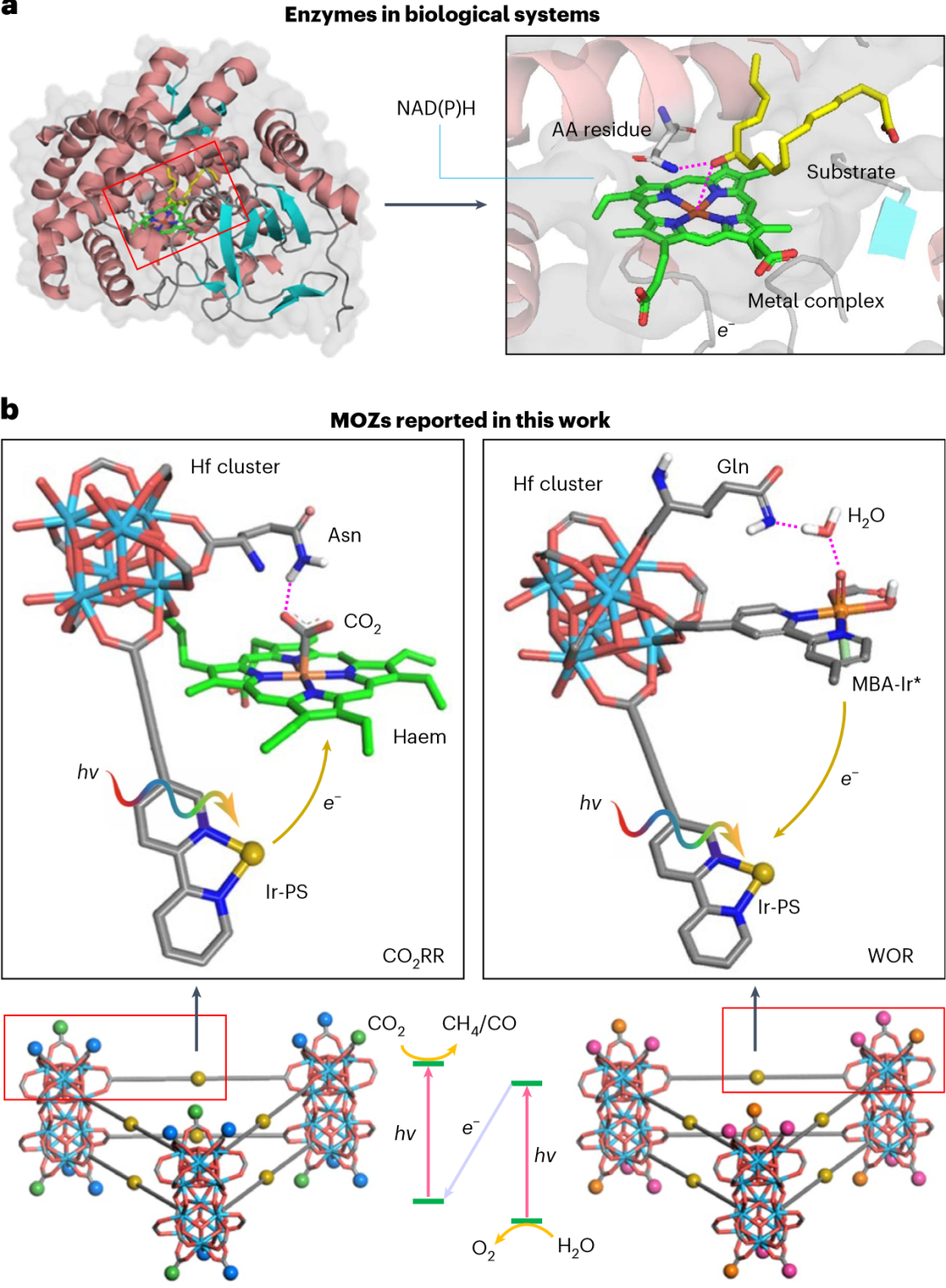
图2.MOZ的设计
在自然界中,酶依赖于由精确排列的金属中心、氨基酸和辅因子组成的活性中心来有效地催化化学反应。例如,金属酶的反应性和选择性来自于与氨基酸(AA)侧链和假体基团配位的金属离子的复杂排列,以及额外的近端AA侧链和辅因子的二级配位球。重要的是,二级配位球通过非共价相互作用稳定过渡态和活性中间体,而辅因子提供电子、氢化物等价物和其他物种来促进反应途径。虽然已经开发了一些人工酶系统,但人工酶系统目前仅限于催化相对简单的反应,缺乏扩大其范围所需的系统可调性。因此需要合理设计一种具有复杂但可调活性部位的人造酶的一般方法,以针对日益具有挑战性的化学转化。
在这里,研究者报告了一种基于金属有机框架的人工酶(金属有机酶,MOZ),它在单个MOF单分子层上精确排列金属中心、氨基酸和色素,以产生定义明确和复杂的活性部位。通过三个步骤系统地优化了MOZ的性能,在这些多样化、筛选和优化过程中,发现带有尿素基团的MoZ-4表现出了高活性和选择性的CO2光催化还原反应(CO2RR),CO和CH4的循环次数分别为24,740和10,352, CO2RR的选择性为98.0%,比均相对照提高了27倍。含有侧基(对氯苯基)的MoZ-7分子筛同样被设计和优化,用于光催化水氧化反应(WOR)。重要的是,MoZ-4和MoZ-7与Co(bpy)32+作为氧化还原介体,实现了(1+n) CO2+ 2H2O → CH4 + nCO + (2 + n/2)O2的完全人工光合作用,其转换频率为98.7h−1,比以前报道的光催化剂性能高一个数量级以上。研究者预计,通过将不同的金属络合物、氨基酸、多肽、人工配体和其他辅因子整合到MOF单分子膜中,可以利用该系统的工作原理来开发其他MOZ,以用于日益具有挑战性的反应(例如,氮气还原和复杂分子的合成)。
3、单金属有机框架嵌入的纳米芯片阵列:控制神经干细胞分化的新方法

第一作者:Yeon-Woo Cho、Seohyeon Jee
通讯作者:Kyung Min Choi、Tae-Hyung Kim
论文链接:
https://www.science.org/doi/10.1126/sciadv.abj7736
发表日期:2022年4月20日
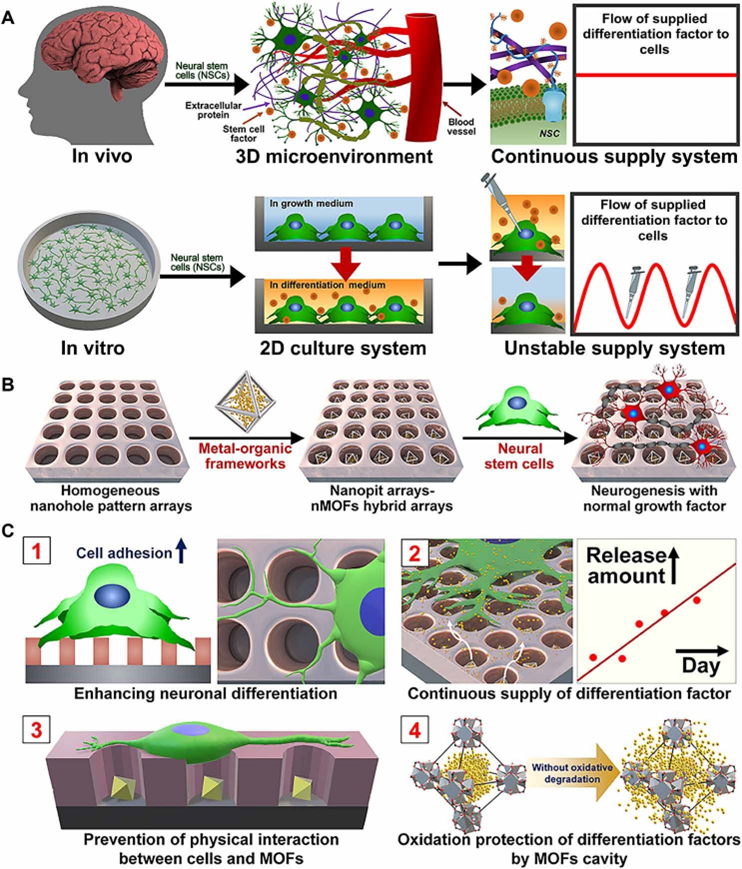
图3.SMENA示意图
在发育过程中,干细胞产生了各种细胞,它们的行为受到几个关键因素的严格和密切控制,包括细胞-细胞相互作用、细胞-环境相互作用和重要营养物质/蛋白质的浓度梯度。稳定和持续的必需生物分子的供应对于模拟体内发生各种类型细胞自发生成的微环境至关重要。
在这里,研究者报告了一种能够长期稳定地向靶细胞释放或供应关键分化因子的新型平台,使用一种被称为单纳米晶体MOF(nMOF)纳米粒子嵌入纳米位阵列(SMENA),它能够促进干细胞的神经发生。首先,作者合成了nMOF,并将其命名为nUiO-67,并对其稳定性和维甲酸(RA)长期释放(>26 天)进行了表征。此后,为了防止细胞与nUIO-67之间的任何物理相互作用并增强细胞在衬底上的粘附性,使用激光干涉光刻(LIL)制备了大规模均匀的纳米阵列。调整纳米粒子的尺寸大小约为450 nm,间距为250 nm(L孔/L间距=0.64),并假设nUIO-67的直径约为177 nm,可以将一个纳米粒子与一个nUiO-67纳米粒子限制在一起,负载效率为98.3%。作为概念验证,选择了神经干细胞(NSCs;NE-4C),它们能够在RA治疗下分化为神经细胞。由于RA⊂nUIO-67提供了稳定的RA供应,并防止了RA在⊂NUIO-67孔中的化学异构化,神经干细胞的体外神经发生显著增强和加速,包括传统的分化方法。总之,开发的Smena平台可以应用于其他干细胞来源和分化谱系,因此对各种基于干细胞的再生疗法有用。
4、MOF中创建模拟酶的纳米孔用于催化

第一作者:Xiaofei Zhang、Caoyu Yang
通讯作者:Guodong Li、Zhiyong Tang
论文链接:
https://www.science.org/doi/10.1126/sciadv.add5678
发表日期:2022年10月7日
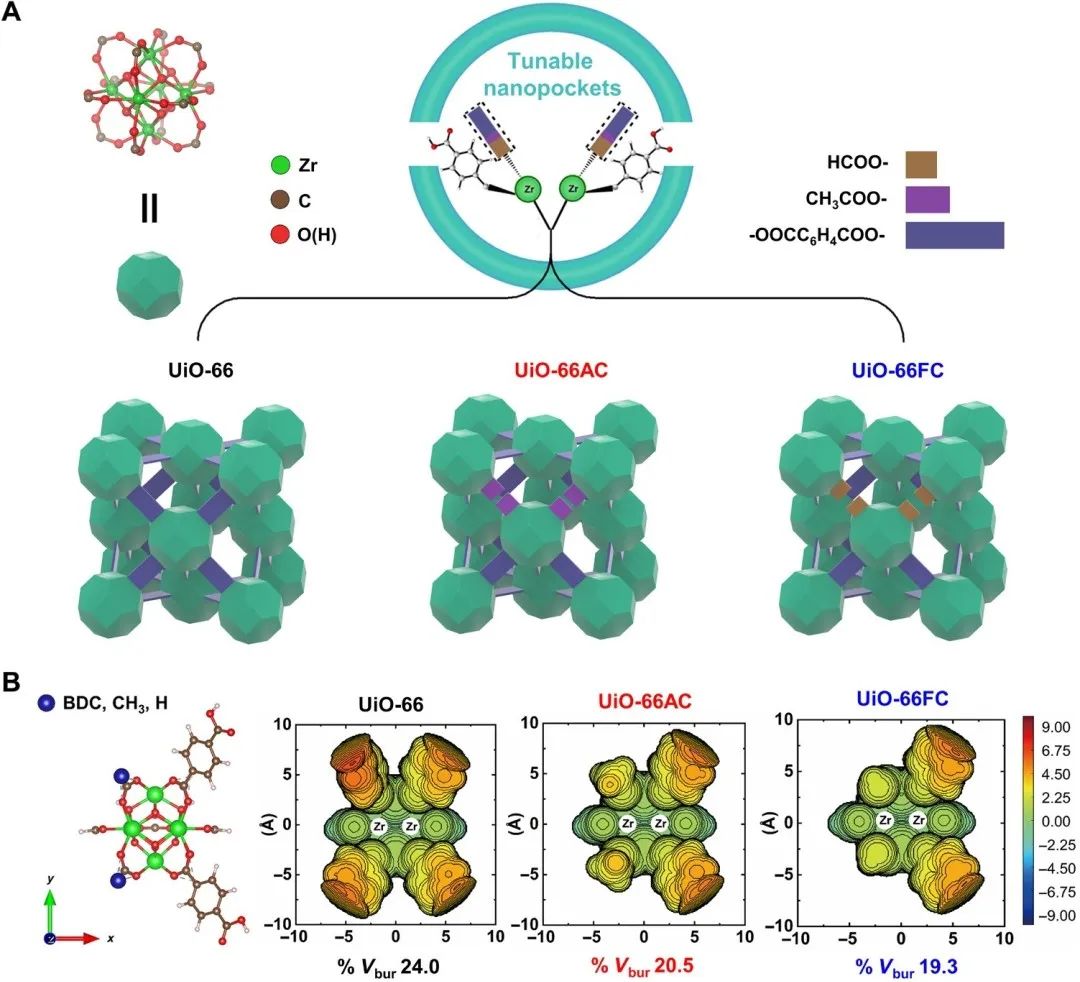
图4. 在对苯二甲酸锆UIO-66中构建具有可调空间的纳米口袋。
酶通常以底物结合口袋中的活性位点为特征,并可通过第二个配位球获得特殊的催化选择性。因此,人们非常希望在人工纳米口袋中构建不同的活性部位,使具有酶行为的底物预组织、过渡态稳定和辅因子控制的调控能够通过多重相互作用发挥作用。目前仿生催化剂的研究主要集中在利用分子筛等经典多孔催化剂中金属辅因子的结构来设计活性中心,但由于刚性支架中缺乏变构效应器而被禁止用于制备底物特定的纳米口袋。
与传统的多孔催化剂不同,金属有机骨架(MOF)由于其有序排列的金属活性中心和有机配体以及可调节的空穴或孔道几何形状提供了类似于酶的受限环境,因此被认为是最适合模拟酶的候选材料。在这里,研究者选择了含有不同调节剂的对苯二甲酸锆UIO-66来考察立体化学环境对其催化活性的影响,因为UIO-66具有与苯二甲酸(BDC)连接体的高配位数,并且在不破坏整个支架结构的情况下对连接体缺陷具有显著的耐受性。针对异丙醇催化乙酰丙酸烷基酯转移加氢合成戊内酯(γ)的问题,通过引入单羧酸甲酸、醋酸或三氟乙酸调节剂,这些调节剂增强了锆位点的活性、选择性和良好的稳定性。令人印象深刻的是,UIO-66FC的催化活性是UiO-66的30倍左右,也优于目前最先进的多相催化剂。有机配体的变构效应和UIO-66纳米内部的多个弱相互作用大大改善了催化性能。
5、MOF应用于细菌感染

第一作者:ZHENG SU、Lingtong Kong、Yong Dai
通讯作者:Jiaxing Wang、Jin Tang、Wenpei Fan、Chen Zhu
论文链接:
https://www.science.org/doi/10.1126/sciadv.abn1701
发表日期:2022年4月8日
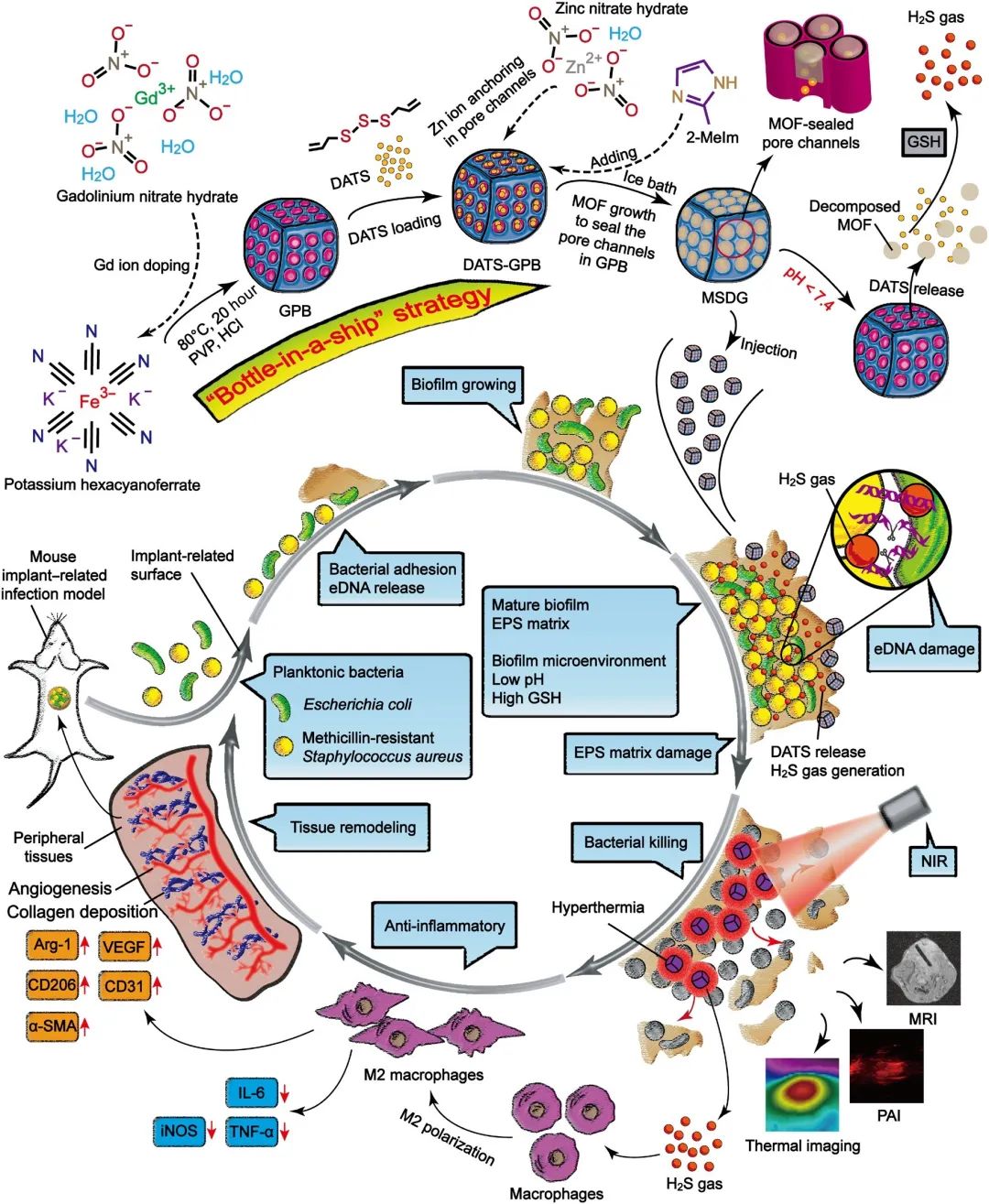
图5. MSDG的设计、合成和生物医学应用示意图
细菌生物膜感染威胁着卫生保健系统和人类福利,并继续导致一些最严重的疾病,如植入物相关感染、感染性关节炎和皮肤病,每年导致全球约1700万人死亡。更糟糕的是,抗生素的滥用加剧了许多病原体出现耐药性。因此,探索其他更具生物相容性和有效性的治疗策略是治疗细菌生物被膜感染的当务之急,同时将副作用降至最低。作为抗生素的替代品,气体传递体[如硫化氢(H2S)、一氧化氮(NO)和一氧化碳(CO)]正在成为有效治疗各种疾病的“绿色药物”。
在此研究者采用一种新颖的“船中瓶”策略将MOF密封在GPB的孔道内(记为MSDG),在中性组织中,MOF是稳定的,因此可以防止二烯丙基三硫(DATS)从GPB中泄漏。当到达生物膜时,MOF被酸性的生物膜微环境(BME)分解,从而允许DATS的释放。释放的DATS可以进一步与还原的BME中过表达的谷胱甘肽(GSH)反应生成硫化氢气体。这最终导致硫化氢气体的目标释放,用于精确的气体治疗,以破坏生物膜内的EDNA。在近红外辐射的GPB产生的热流的辅助下,精心设计的MSDG可以产生H2S敏化的热疗,以消除大多数生物膜。利用BME反应的H2S释放标志着精确的生物膜特定气体治疗的开始,以显著降低热疗的温度阈值,从而对未受影响的组织的任何潜在附带热损害降至最低,并确保整个治疗过程的安全性。研究表明,MSDG介导的M2巨噬细胞可以促进感染诱导的促炎环境的逆转。大量与再生相关的细胞因子的分泌加速了生物膜后的组织重建,这有利于对抗种植体相关的感染。







暂无评论
发表评论