1引言
在肿瘤的靶向治疗研究中,靶标是非常重要的环节,然而,任何给定的标记都可以在靶细胞和其他细胞上表达,包括“旁观者”、肿瘤细胞和正常细胞。例如,乳腺癌生物标志物HER-2也在肺表皮细胞上表达。由于通常没有肿瘤特异性抗原,特别是实体肿瘤,所以单一生物标志物识别会导致包括“在靶,却脱离肿瘤”现象在内的假阳性反馈。为了提高细胞靶向的特异性,许多科学家开发了基于逻辑的双标记或多标记控制纳米器件,意图实现更加精确的靶向。然而,一些典型的串联逻辑纳米器件由溶液中多个自由扩散的分子成分组成,从而导致低和慢的逻辑响应。
核酸适配体参与的DNA纳米技术已成为一种快速且有前景的方法,用于感知、处理和响应复杂的细胞环境,其具有高度的特异性、可编程性和生物计算能力等优点。为了解决前述问题,基于链置换反应(SDR)的DNA纳米组件有助于在细胞膜上实现更安全、更快速的DNA逻辑门控靶向,尤其是对于邻近驱动信号的激活。这些DNA纳米装置组装多个单元来操纵蛋白质聚合,区分细胞类型并放大生物传感和生物成像。然而,现有的基于适配体的纳米组件也有许多问题需要解决,比如非特异性内化、可能的泄漏问题以及由于多周期或多分子输入的引入引起的系统复杂性和副反应的增加。因此,如何做到仅靠一种分子的一次性输入就可破译出多种肿瘤细胞的原位和快速诊疗成为该领域的巨大挑战。
2课题设计
因此,湖南大学谭蔚泓院士课题组构建了一个固定在活细胞膜上的二阶DNA逻辑纳米机器人(DLGN),能够同时实现多路复用诊断和协同治疗。该纳米机器人DLGN(图1a)负载了3种识别靶标的核酸适配体,3种荧光分子和2种药物分子。DLGN躯干是血清中稳定的DNA四面体支架,手臂是支撑以停泊在负电的细胞膜上的链霉亲和素SA,脚是能站立在膜表面用于识别相应受体而后能释放解码链的两种适配体组件(MUC1和EpCAM),头是能被两条解码链置换后释放的效应器件,即核酸适配体药物偶联物(EASDs)。DLGN的作用机制如下:首先,每个适配体的荧光通过其部分互补的DNA链(CDNA)通过荧光共振能量转移(FRET)效应被淬灭。当活细胞遇到DLGN时,不同标记物的高表达会去除相应的受体脚趾的cDNA,然后,具有大电负性的臂会帮助DLGN锚定在与受体结合的细胞膜上。此步骤避免了直接内吞,并导致“一个细胞一个条形码”的荧光模式。特别是当靶细胞高度表达三个标记物(PTK7、MUC1和EPCAM)时,二阶逻辑门被前两个阻断链激活,释放效应体头部,导致荧光或协同药物作用(图1b)。
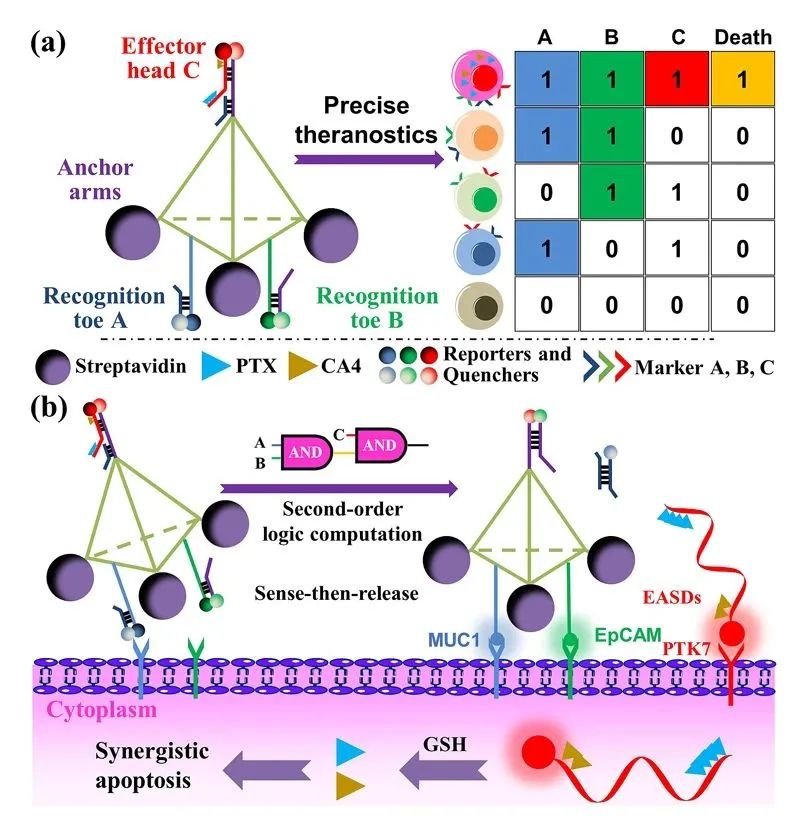
图1 DLGN解码多种细胞的分型和靶细胞的诊疗一体化
a. DLGN的组成部分以及其逻辑门控概念示意图;b. DLGN在细胞膜表面的靶向诊疗作用示意图
3研究结果
在通过流式细胞术筛选出合适的适配体后,并将其与药物组装为头部DTS后,需要加上臂将它们组装为DLGN。通过荧光琼脂糖凝胶电泳方法验证了不同数量的链球菌蛋白改性DLGN的精确组装(图2a)。加入链球菌蛋白后,DLGN的水动力学尺寸大于DTS(27.1±6.4nmvs. 20.2 ±1.8nm),阻滞剂链稳定了柔性单链DNA,与理论估计一致。为了证实加上负电性的臂后会避免细胞的内吞,该团队制备了有胆固醇标记的DTS(chol-DTS)和无标签的DTS(自由-DTS)作为对照,与结合上SA的DTS对比,以检查细胞结合和可能的内吞。实验结果如图2c所示,SA的加入确实能有效避免细胞内吞。在没有靶标的阴性对照细胞系中也没有出现内吞等能导致“假阳性”出现的现象。
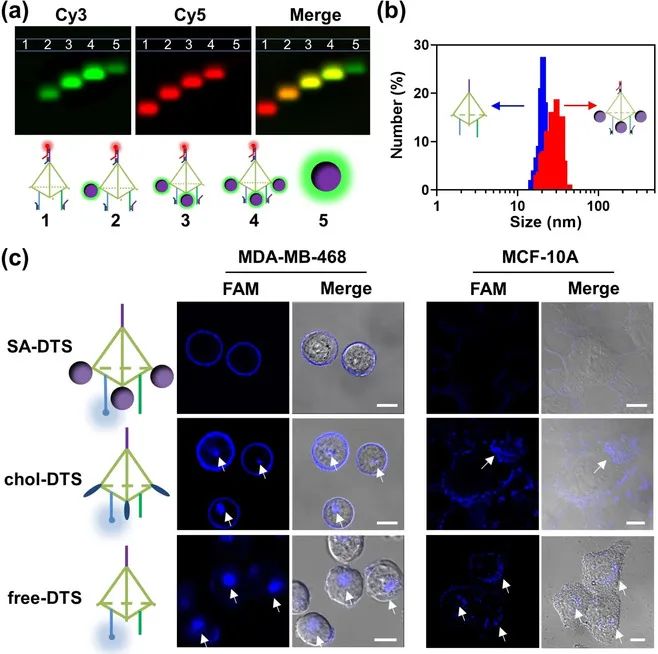
图2 实验验证链霉亲和素修饰的DLGN的自组装(a)SA 修饰的 DLGN 逐步组装的 2 % AGE 分析;(b)通过动态光散射得到 DTS 和 DLGN 的 流体动力学尺寸结果;(c)共聚焦图像
在分子机器人构建成功后,通过加入对构成脚趾适配体对应的cDNA来验证纳米机器人作为“靶向释放”逻辑门控的可行性。该团队在三个适配体和它们各自的cDNA上设计了三个FRET对作为响应多个cDNA或标记输入的逻辑开关(图3a)。在用cM*或cE*处理DLGN后,“YES”门被激活以分别释放FAM或Cy3信号(图3b-3c)。而且只有当cM*和cE*共存触发“AND”门时,Cy5强度才会升高(图3d)。
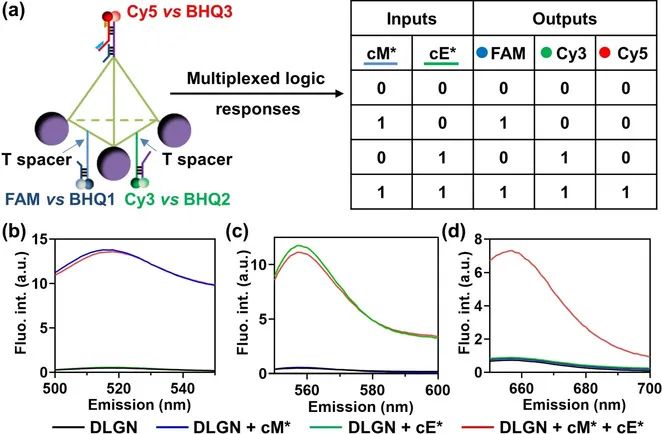
图3 逻辑门控操作的可行性测试实验(a)DLGN 基于多个 cDNA 输入和多个荧光输出执行多路逻辑响应; 在激发波长 490 nm (b)、540 nm (c) 和 640 nm (d) 下用 cDNA 输入处理的 DLGN 的荧光强度变化
最后,该团队验证了DLGN作为一次性输入纳米器件导致多种癌细胞分型诊疗的可能性。如图4b所示,当不具备任何靶标的MCF-10A细胞与DLGN一起孵育时,由于这个“非”逻辑门,因此没有荧光信号。Hela和HePG2细胞分别显示蓝色FAM荧光和绿色Cy3荧光,因为这里设计了“INH”门(MUC1ANTEpCAM,或EpCAM和NOTMUC1)。值得注意的是,这两个细胞系过度表达了标记C,PTK7,但没有红色的Cy5荧光。这要归因于我们将DLGN构建为一个二阶逻辑门控纳米机器人,只有当第一个“和”门被触发时,才能访问其第二门。因此,MCF-7细胞表现出蓝色FAM信号和绿色Cy3信号,而只有三阳性的MDA-MB-468显示了三通道荧光,也即“AND AND”逻辑门。同时,流式细胞术和共聚焦显微镜也证明了对应的细胞靶向死亡现象,进一步表明了该逻辑控制纳米机器人的靶向诊疗能力。
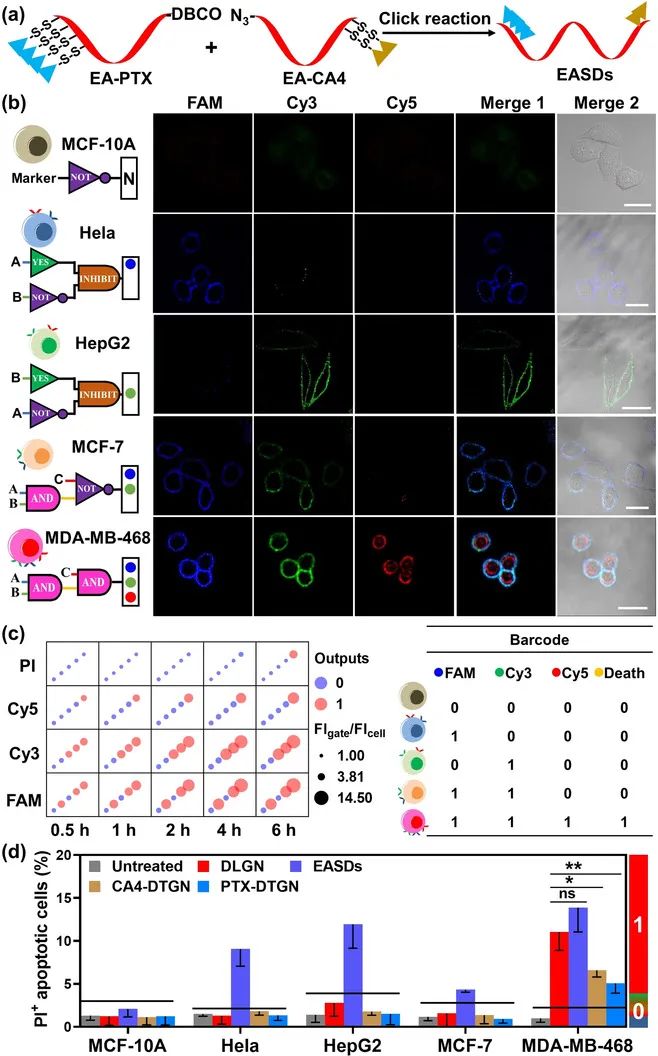
图4 将DLGN用于多重诊断,可识别五种细胞系并精确协同杀伤靶向肿瘤细胞
4总结
综上所述,本工作从逻辑门控制的DNA网络和活细胞中的生化信号转导中获得灵感,成功设计了一个强大的DNA纳米机器人,实现了五种细胞系之间的多重诊断和靶向杀伤。DLGN可以在半小时内区分各种相似细胞系中作为靶标的抗原(PTK7)的不同表达水平,并在六小时内原位血清杀死靶肿瘤细胞,消除了靶上抗原脱靶细胞现象。本工作构建了一种集成化的智能的DNA纳米机器人,只需要一次性输入这种分子即可自动化地完成多种肿瘤细胞的分型和特定肿瘤细胞的靶向杀伤。可以想象,这种合理设计的DLGN纳米机器人的躯干、脚趾、手臂和头部,可以激发其他更智能的分子机器人工程,将为生物医学去破译更多的其他基础研究,应用研究和临床问题。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202103993
DOI:10.1002/anie.202103993







暂无评论
发表评论