研究背景
光动力疗法(Photodynamic therapy, PDT)由于具有选择性高、时空精度高、无创、可控性好、毒性低、可重复治疗等优点,在癌症治疗中具有较大应用前景。PDT过程经常会涉及单线态氧(1O2)的光敏化,该过程利用氧气产生有毒的活性氧(reactive oxygen species, ROS),并通过ROS诱导癌细胞凋亡,从而抑制肿瘤的生长。
然而,持续的PDT过程会迅速消耗细胞内的氧储备,损伤肿瘤血管并形成固有的缺氧微环境,这严重限制了光疗效果。由于1O2的寿命短(10-320 ns),在细胞中的扩散距离短(10-55 nm),其在内质网中积累量少,而内质网的应激效果与PDT诱导癌细胞凋亡密切相关,使得该方法的抗肿瘤效果有限。
蒽已被证明是一种能够增强光敏剂三重激发态的非重原子基团,未取代蒽的系间窜越效率(ΦISC)高达70%。蒽类化合物能够增强光敏化中的ISC过程,其衍生物可以通过直接能量转移产生1O2。它们通过环可逆反应,形成稳定的内过氧化物中间体并释放1O2,整个过程无副反应。
NIR-Ⅱ荧光成像是一种无创成像方式,由于其背景极低、分辨率高、组织穿透深,可以将目标病灶与周围组织区分开。BODIPY化合物由于具有较高的摩尔吸收系数和优异的光稳定性,是一种有潜力的光治疗化合物。然而,由于BODIPY衍生物的带隙相对较宽,其NIR-II发射特性很少被报道。
当前,原位可逆化学捕获和1O2的缓慢释放被认为是提高暗态下1O2寿命的合适策略。在这项工作中,新加坡国立大学陈小元教授等人通过合成三种类型的BODIPY衍生物,证明了蒽官能化的BODIPY衍生物ASBDPTPA是一种能够实现单线态氧1O2可逆捕获和释放的高效无重原子光敏剂,这种1O2“余辉”策略为光学治疗提供了新思路。
原文链接
Zou, J. et al. Singlet Oxygen “Afterglow” Therapy with NIR-II Fluorescent Molecules. Advanced Materials. 2021
https://doi.org/10.1002/adma.202103627
研究内容
在这项工作中,研究人员合成了图1中的三种BODIPY衍生物BDPTPA、BDPA与ABDPTPA并进行了基本性质表征。
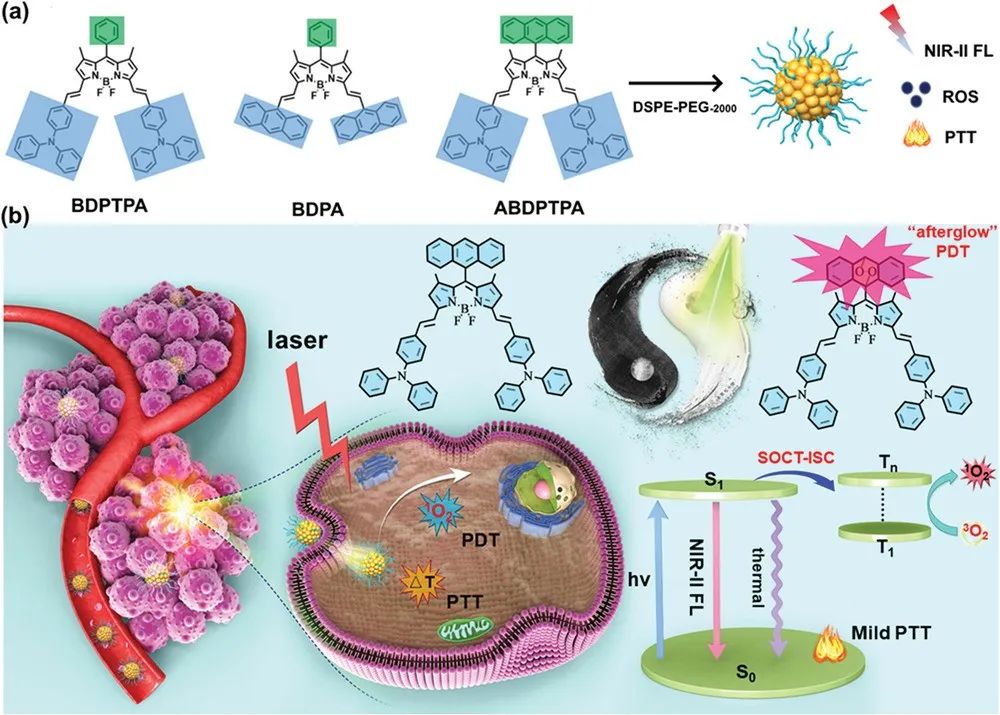
图1. (a) BDPTPA、BDPA与ABDPTPA的结构图; (b) ABDPTPA纳米粒子通过1O2“余辉”效应增强光疗机理图解
如图2所示,研究人员通过纳米沉淀法制备了三种纳米粒子(NPs),紫外-可见吸收光谱表明三种纳米粒子的最大吸光度在近红外区,在用808 nm激光激发后,ABDPTPA纳米粒子在1000 nm处显示出强发射峰,证明其适用于NIR-Ⅱ荧光成像。而由于其强近红外吸收,在光照射过程中会产生热效应,促进血液循环,增加肿瘤中局部氧气浓度,进一步提高PDT的疗效。
通过计算可知ABDPTPA纳米粒子的光热转化效率为20.2%,其产生的局部高温能够诱导血管正常化,并导致微血管密度的降低和周细胞覆盖率的增加,减少肿瘤缺氧情况。
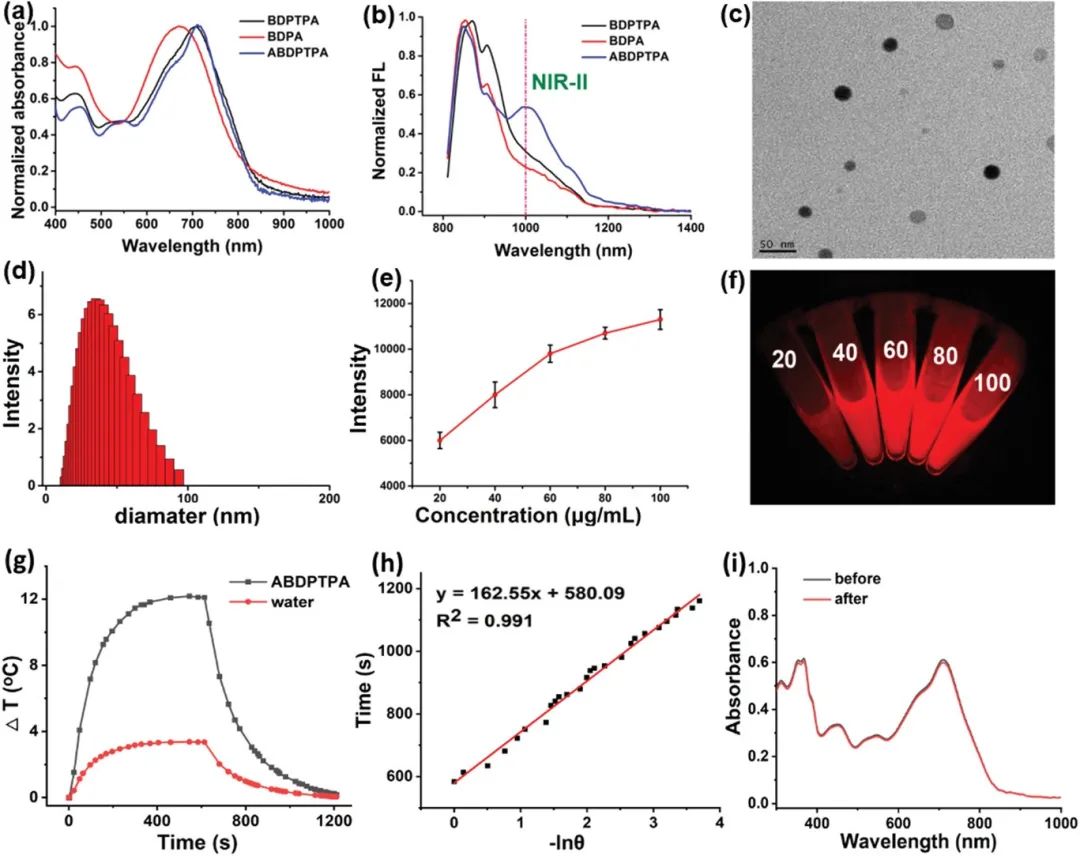
图2. BDPTPA、BDPA与ABDPTPA的(a)吸收光谱; (b)荧光光谱; (c)TEM图像; (d)DLS结果; (e)荧光强度曲线,ABDPTPA NPs的(f)不同浓度荧光成像; (g)有无激光下的温度变化曲线; (h)-lnθ与时间的线性拟合曲线; (i)照射3分钟后吸收光谱.
光敏剂产生1O2的能力对于实现高效PDT过程十分重要,由于ABDPTPA系间窜越的自旋轨道电荷转移,ABDPTPA在二氯甲烷中的量子产率高达60%,远高于BDPTPA与BDPA的1.2%与8.3%。ABDPTPA高效的系间窜越能力,使其具备最高的1O2量子产率。
ABDPTPA的光动力过程机理分为两部分,第一部分是1O2的捕捉,在光照射下蒽与1O2形成了蒽内过氧化物;另一部分是1O2的释放,在黑暗环境下,蒽内过氧化物返回蒽,并缓慢释放1O2。如图3e所示,该工作中通过观察DPBF的降解,首次在二氯甲烷中研究了ABDPTPA的“余辉”能力,在照射溶液后的1min内连续监测,于黑暗环境下仍能够观察到DPBF的进一步降解,证明了该化合物的连续1O2释放能力。
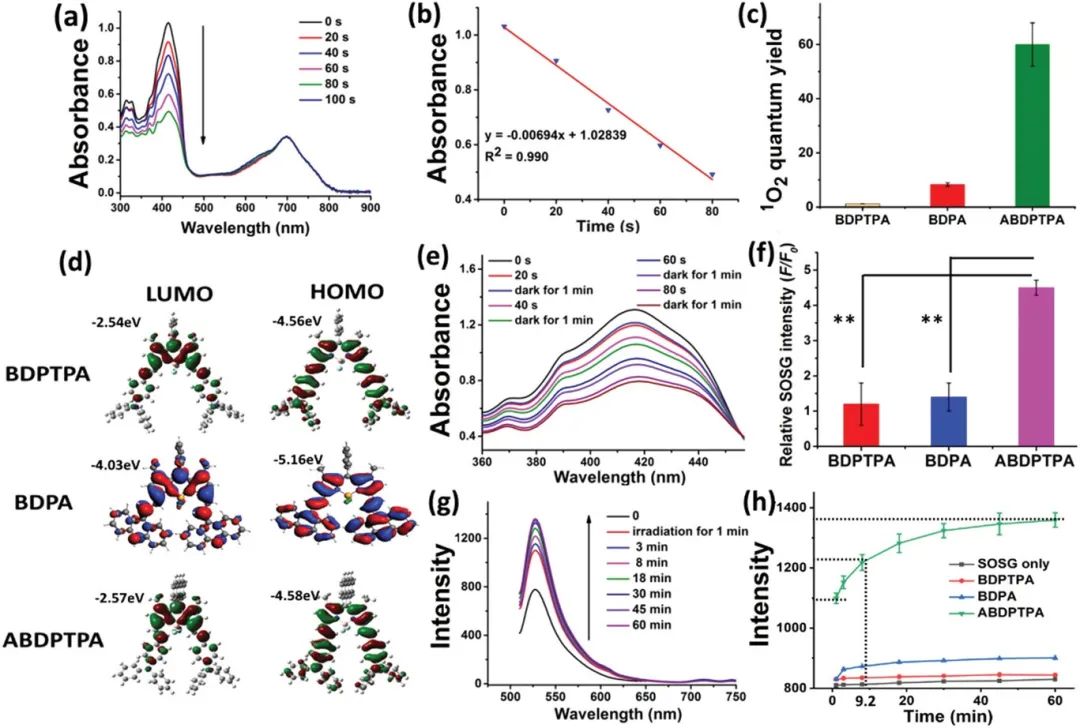
图3. (a)DPBF降解情况; (b)DPBF降解线性拟合; (c)1O2量子效率比较; (d)几何结构优化; (e)暗态下DPBF在ABDPTPA中的衰减; (f)辐照4分钟后的相对荧光强度; (g)辐照1分钟后存在ABDPTPA NPs的SOSG的荧光强度; (h)辐照1分钟后的对照荧光强度
有机光敏剂的纳米粒子在水溶液中通常容易出现分子聚集,而引发荧光与单线态氧的猝灭。在这项工作中,研究人员以SOSG为探针,探究了NPs的1O2产生能力,在激光辐射下,SOSG荧光强度提高了4.4倍,证明了ABDPTPA具有强1O2生成能力。
进一步研究了单线态氧的捕获与释放,由于ABDPTPA“余辉”效应,1O2的半衰期延长至9.2分钟。
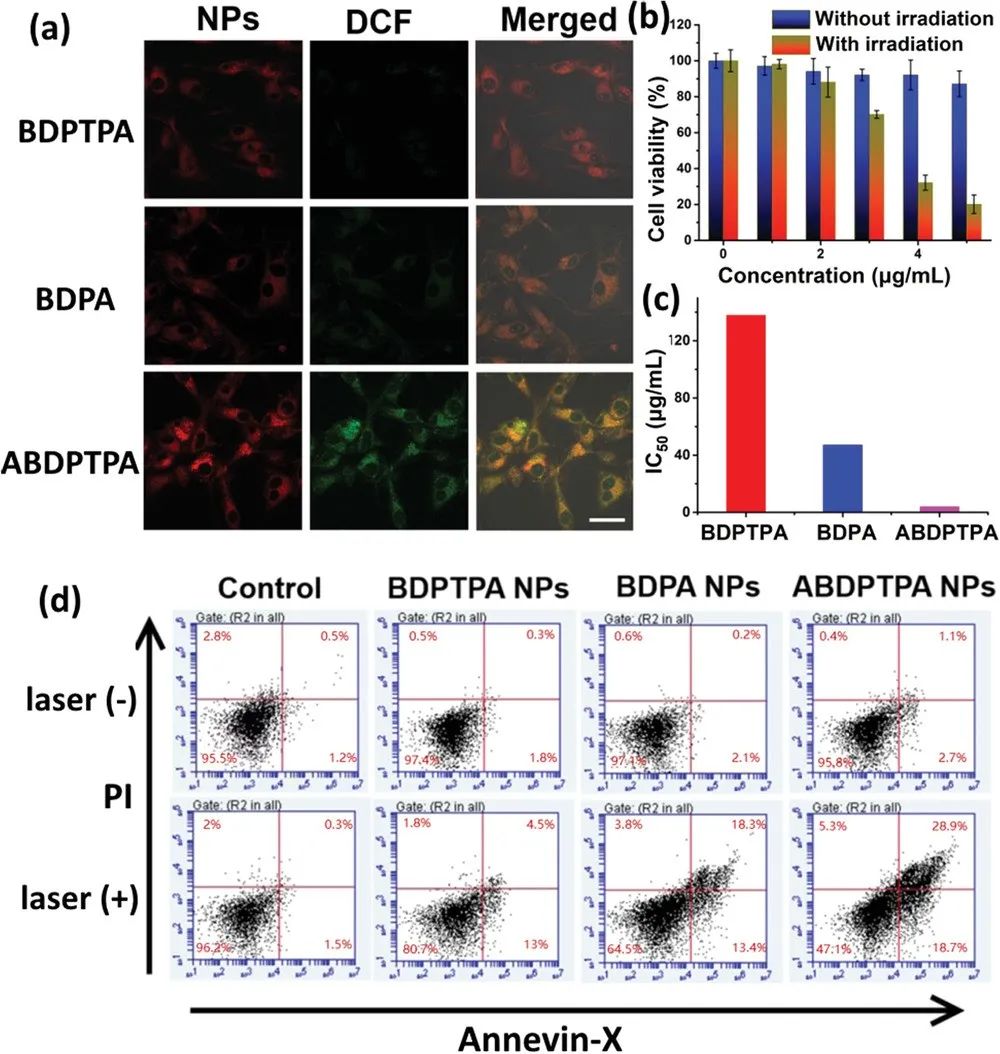
图4. (a)细胞摄取NPs并光照2min后的CLSM图; (b)不同浓度ABDPTPA NPs辐照前后的MTT测试; (c)IC50值比较; (d)流式细胞术测定辐照前后的NPs
为了研究三种NPs的光疗效果,评估了其细胞毒性。使用共聚焦激光扫描显微镜(CLSM)研究了细胞对于三种NPs的摄取情况。如图4a所示,以DCFH-DA为探针,经过辐照后细胞内产生的活性氧氧化了DCFH-DA,并产生具有绿色荧光的DCF。
实验结果表明ABDPTPA NPs具有最亮的绿色荧光,证明其能够高效产生ROS。体外细胞毒性实验显示,ABDPTPA NPs对U87MG细胞的半最大抑制浓度(IC50)为3.6 µg mL-1,它能够诱导U87MG细胞产生典型的凋亡。上述结果证明了ABDPTPA纳米粒子能够应用于光动力疗法。
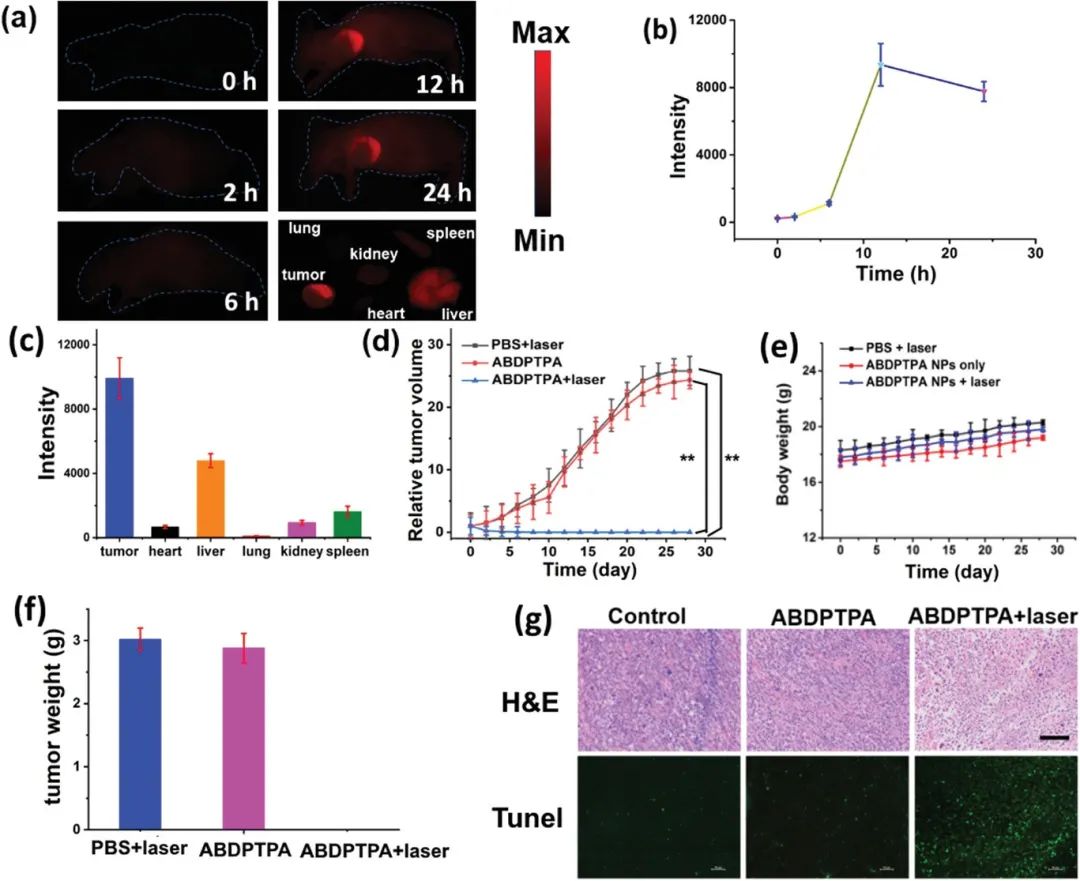
图5. (a)裸鼠的NIR-Ⅱ荧光成像; (b)小鼠肿瘤荧光强度; (c)24小时后裸鼠的肿瘤及各器官的荧光强度; (d)各处理条件下相对肿瘤体积; (e)治疗期间小鼠体重; (f)不同组小鼠肿瘤重量;(g)肿瘤的H&E和TUNEL染色图像
进一步研究了ABDPTPA NPs对小鼠肿瘤的近红外荧光成像能力。如图5a所示,APDPTPA NPs通过强的穿透性与滞留效应被动靶向肿瘤。在注射12小时后,肿瘤的荧光强度达到最高。荧光量化和生物分布结果显示其在肿瘤中有更多的积累,证明ABDPTPA NPs具有良好的肿瘤靶向作用。
在对小鼠注入ABDPTPA NPs与PBS后,使用730 nm激光进行照射治疗,8分钟后,红外热成像显示肿瘤温度上升至47.4°C。对小鼠进行光动力治疗,并每两天记录一次肿瘤体积,结果显示ABDPTPA NPs能够完全抑制肿瘤生长,并且治疗后小鼠体重仅轻微增加,说明ABDPTPA NPs与PBS的低暗毒性。对于治疗结果进行H&E与TUNEL分析,证明ABDPTPA NPs在激光照射下可诱导肿瘤细胞死亡,且暗毒性可忽略不计。
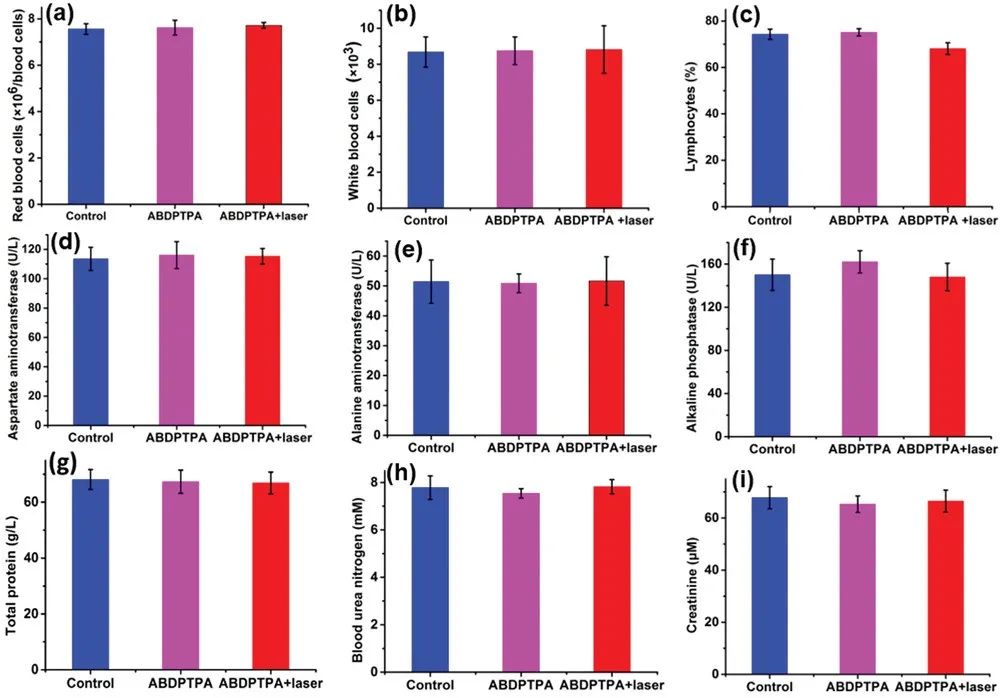
图6. PBS+激光、ABDPTPA NPs与ABDPTPA NPs+激光组小鼠的(a)红细胞; (b)白细胞; (c)淋巴细胞; (d)天冬氨酸氨基转移酶; (e)丙氨酸氨基转移酶; (f)碱性磷酸酶;(g)总蛋白;(h)血尿素氮;(i)肌酸酐参数
通过对正常器官进行H&E染色,以研究ABDPTPA的生物相容性。结果显示细胞核保持良好状态,细胞形态正常,证明了ABDPTPA NPs的低毒性。此外还研究了血液学参数、肝与肾功能参数,经ABDPTPA NPs处理后均未出现不良反应。上述结果证明,ABDPTPA纳米粒子是一种能够应用于光学治疗的生物相容性纳米药物。
小结
本文提出使用1O2“余辉”策略用于肿瘤治疗。该策略利用蒽与BODIPY的结合通过自旋轨道电荷转移增强了ISC效应,从而实现了1O2的可逆捕获与释放。
ABDPTPA纳米粒子成功延长了1O2半衰期至9.2分钟,具有较强的1O2生成能力,且毒性较低,适合用于由NIR-Ⅱ成像引导的低剂量光疗。该材料经激光照射有效抑制了肿瘤的增殖,且无不良反应。本工作证明了通过1O2“余辉”策略能够进一步发展肿瘤的光学治疗。



暂无评论
发表评论