前言
根据世界卫生组织2015年的统计,癌症是172个国家中91个国家70岁以前的第一或第二大死亡原因,在另外22个国家中排名第三或第四。
每年有接近430万人被诊断为癌症,在中国,每分钟就有超过8人被确诊为癌症,癌症仍然是全球公共卫生的重大威胁,迫切需要新的肿瘤治疗方法。
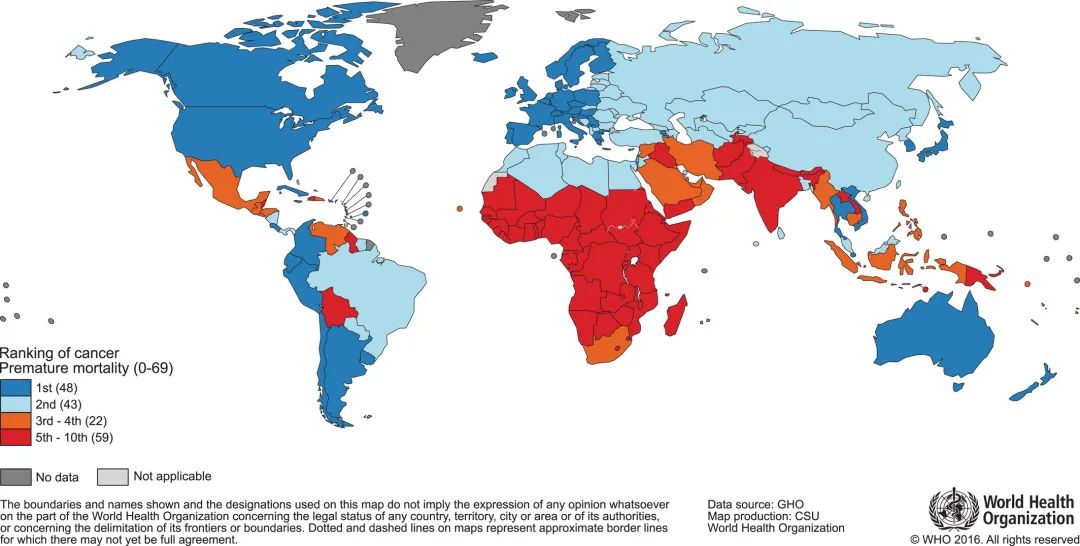
图1. 2015年全国70岁以下人群癌症死因排名
(图片来源:世界卫生组织)
★肿瘤治疗现状
当前大多数癌症的临床治疗存在着严重的副作用,且会出现肿瘤的转移,扩散和耐药突变的情况。
纳米药物目前已经广泛应用于临床,因为其能够精确定位肿瘤的位置,并最小化对正常细胞的损伤。临床目前批准的纳米药物治疗方法包括:光热疗法、光动力疗法等。
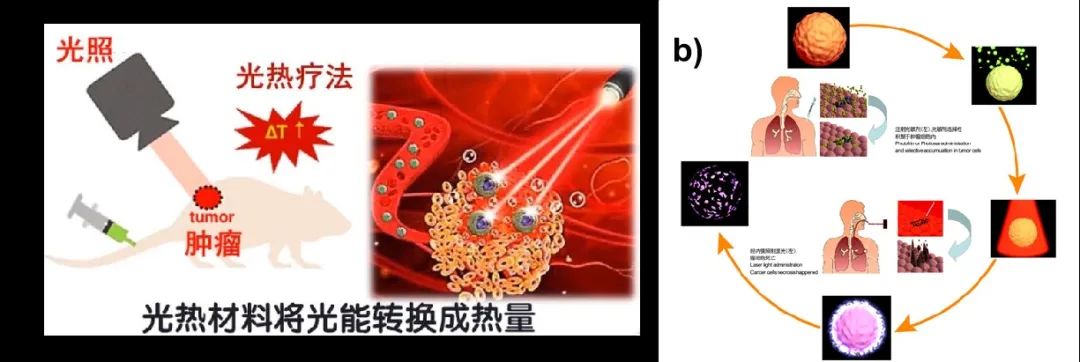
图2. 光热疗法与光动力疗法示意图
(图片来源:www.bilibili.com)
光热疗法(PTT),指利用纳米粒子的光热效应产生42°C以上的局部热量杀死癌细胞的技术。PTT具有独特的优势,例如微创性和高效性。
然而,光热剂(PTA)的金属和碳基纳米材料难以代谢,会对大脑、肾脏、肝脏和其他器官造成累积毒性和永久性损伤。而有机小分子类PTA具有相对较低的光热稳定性和光热转换效率,也限制了其临床方面的应用。
光动力疗法(PDT),指主要利用光敏剂和氧气等产生ROS并杀死癌细胞的手段。由于 ROS是来自氧分子的化学反应性自由基或非自由基分子,可以损伤多种癌细胞,且重复治疗不存在耐药性。尽管有这些优点,但在缺氧的肿瘤微环境中这种方法通常效率低下并且需要重复治疗。
★研究思路
清华大学朱永法团队与中科院理化技术研究所的关山月团队合作,开发了一种全新的、利用强氧化性光生空穴的癌症治疗方法,实现了对癌细胞与实体瘤的快速杀灭,该工作发表于《中国科学》杂志社旗下的National Science Review期刊上。
有机超分子光催化剂具有光谱响应宽、消光系数高以及能带结构可调控的优点,基于有机超分子光催化材料,光催化癌症治疗利用共轭有机超分子光催化剂可在穿透能力较强的红光下产生强氧化性光生空穴的特性,克服了传统光疗法对缺氧肿瘤组织中氧气的依赖,对肿瘤细胞和实体肿瘤组织进行彻底氧化杀灭,无转移和复发风险,从而实现了对于癌症的高效治疗。
同时,有机超分子光催化抗癌材料具备更为优异的生物相容性,对正常细胞和组织无损伤副作用,可被生物代谢降解,是一种更为安全的疗法。因此,有机超分子可见光催化剂对癌症的快速、低损伤、完全治疗对人类健康具有重要意义。
文章链接
Zhang, Z., Wang, L., Liu, W. et al. Photogenerated-hole-induced rapid elimination of solid tumors by the supramolecular porphyrin photocatalyst. National Science Review, 2021, 8, nwaa155.
https://doi.org/10.1093/nsr/nwaa155
★讨论与总结
Nano-SA-TCPP在红光下的肿瘤治疗能力
如图3所示作者制备了尺寸均一的纳米粒子Nano-SA-TCPP,高分辨率透射电子显微镜可以观察到超分子材料优异的结晶性能。
Nano-SA-TCPP的吸收范围达到近红外,较长的波长有利于生物组织穿透到靶区,而600-1200 nm的区域被认为是治疗窗口,因为生物组织吸收较少。
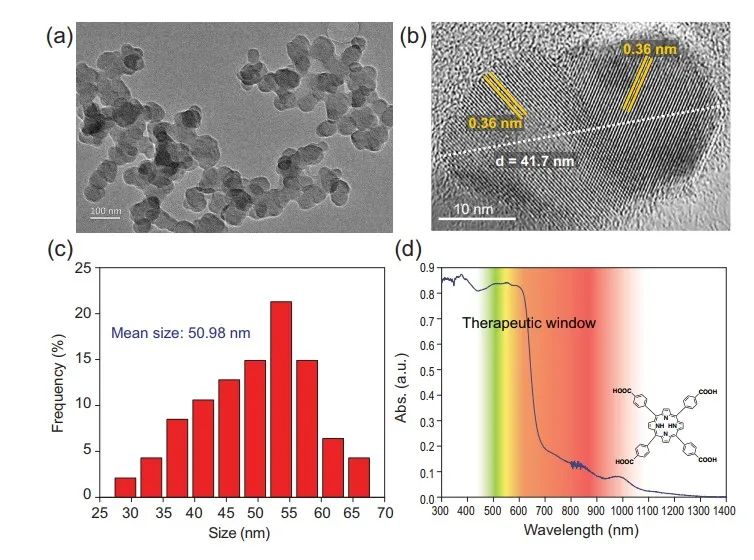
图3. Nano-SA-TCPP的表征
如图4(a)(b)所示,研究人员使用约100 mm3的皮下肿瘤模型来测试治疗效果。用 0.1 W cm-2的600 nm光照射注射Nano-SA-TCPP的肿瘤部位10分钟后,实体瘤部位明显萎缩变平,一周后脱落,露出新恢复的组织。
为了验证红光下的抗癌性能,还研究了体外对照实验。Hela 细胞与 Nano-SA-TCPP 分散体一起孵育,并在 600-700 nm 下照射。
可以看出的是,Nano-SA-TCPP 分散体 25 μg mL -1 600nm下10分钟内可完全杀死Hela细胞。对于光催化治疗组实现了完全治愈,与对照组相比,经历光催化小鼠的50天存活率有所提高,接受治疗的小鼠保持健康,未接受治疗的对照组则全部死亡。
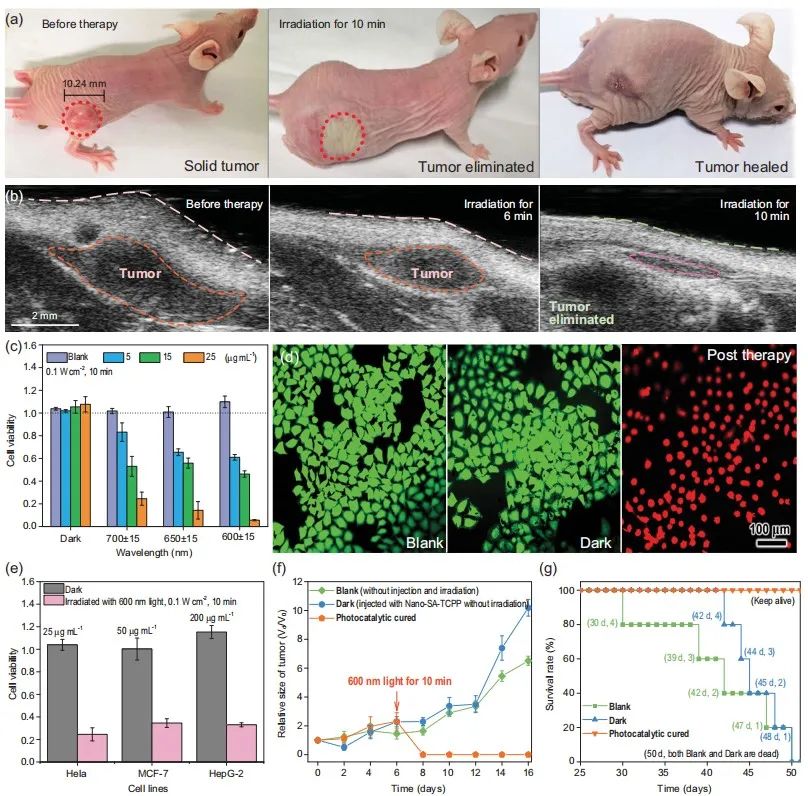
图4. Nano-SA-TCPP 的光催化癌症治疗
Nano-SA-TCPP的靶向特性
Nano-SA-TCPP可以进入癌细胞并均匀分布在细胞质中,Nano-SA-TCPP在Hela细胞和正常细胞中含量呈现的显着差异。
Nano-SA-TCPP在Hela的大量内化。而在正常细胞中,Nano-SA-TCPP被阻断在细胞外。该材料的靶向特性是由癌细胞和正常细胞之间的细胞吞噬作用的大小选择效应引起的。
通过尾静脉注射 Nano-SA-TCPP 分散体进一步测试体内靶向特性,由于纳米-SA-TCPP 的靶向性和增强的渗透性和保留作用,可观察到它在实体肿瘤部位富集肿瘤部位的荧光强度明显高于其他器官。
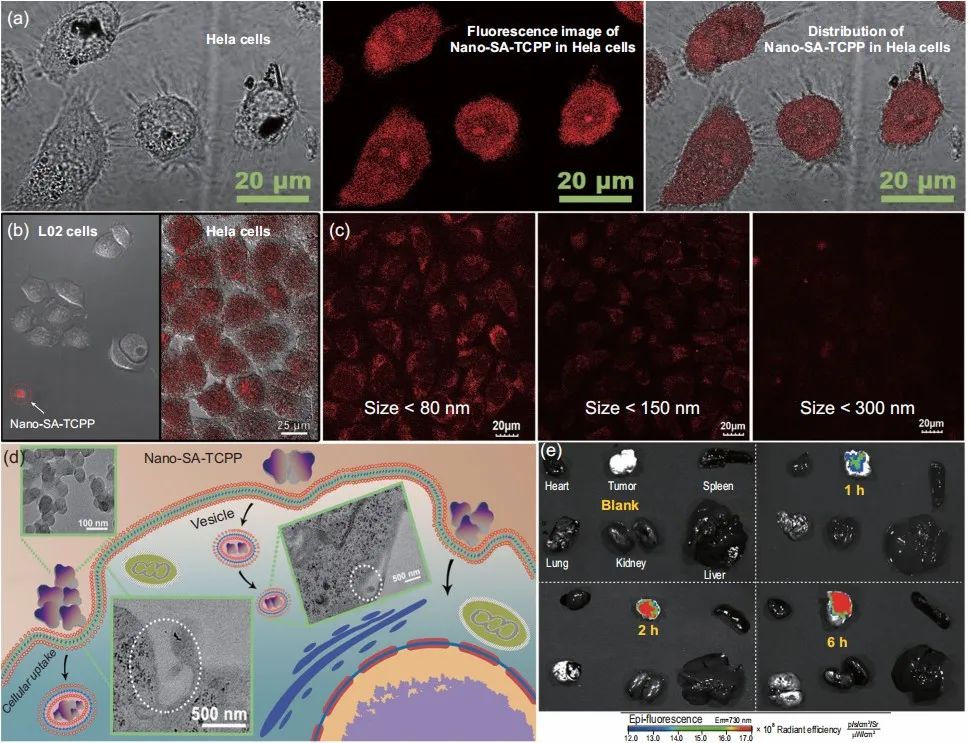
图5. Nano-SA-TCPP的细胞摄取和靶向特性
Nano-SA-TCPP的生物相容性
将不同浓度的Nano-SA-TCPP分散体与Hela细胞孵育。在低于50mg/mL的浓度下对增殖没有显著副作用,实验期内,小鼠的生活质量没有受到影响。
而由于不具有金属元素,Nano-SA-TCPP可以完全代谢,Nano-SA-TCPP在肿瘤部位的含量先增加后减少,说明有机物没有引起累积毒性。
注射后6小时出现肿瘤部位的最大浓度,而全身最大浓度出现在注射药物后24小时,这是全身代谢滞后所致。随着观察时间的延长,240小时后Nano-SA-TCPP完全代谢,全身荧光恢复到背景水平。
Nano-SA-TCPP的注射没有损害的主要器官。光催化治愈的小鼠保持健康,实体瘤被消除。在对照组中,实体瘤生长迅速。
此类实验结果证明光催化疗法对实体瘤具有显着的治疗效果,可在10分钟内清除实体瘤组织。这种出色的治疗效果和生物安全性,是传统光疗方法所不具备的。
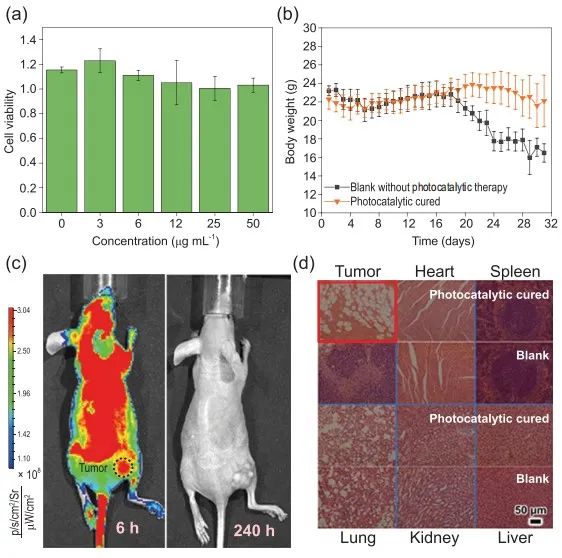
图6. Nano-SA-TCPP的生物安全特性
光生空穴诱导癌症治疗的机制
研究人员揭示了其中的机制,光生空穴是在光激发后在半导体光催化剂表面形成的高能氧化态,利用这种强氧化能力强到可以破坏小分子。
光催化疗法利用高氧化性光生空穴,它摆脱了对氧气的依赖。使用表面光电压技术,可以确定在红光下 Nano-SA-TCPP 上光生空穴的产生,如图7所示。Nano-SA-TCPP 中光生空穴的氧化电位为 + 1.53 V,可以氧化污染物和水分子。
而光生空穴的存在通常需要依赖于半导体固体,单独的分子不能够形成光生空穴。因此,我们还比较了Nano-SA-TCPP与Ce6和分子TCPP 的性质。
由于这些分子药物不具有半导体能带结构,因此在相同的照射下无法检测到光生空穴信号。因此,与Nano-SA-TCPP相比,分子药物对癌细胞的杀伤作用要弱得多,这也是 Nano-SA-TCPP与典型PDT的最大区别。
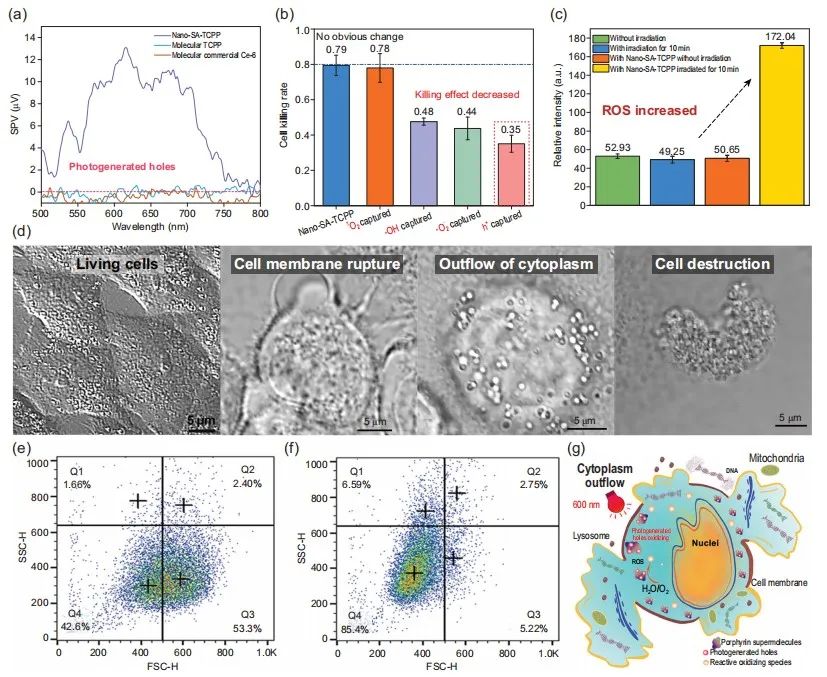
图7. Nano-SA-TCPP光催化治疗癌症的机制
结论
朱永法团队基于超分子卟啉光催化剂开发了一种新的癌症治疗方法。该疗法利用超分子光催化剂通过红光照射下产生的光生空穴来进行肿瘤治疗。
超分子光催化剂还可以富集于癌细胞和肿瘤,且不会对正常组织和器官造成损害。同时,超分子卟啉光催化剂具有良好的生物安全性。
随着光催化材料的进一步开发和对机理理解的进步,预计光催化癌症治疗将在攻克肿瘤方面发挥重要作用。



暂无评论
发表评论