全文速览
在肿瘤微环境中,CD4+ T 细胞可以通过识别人类白细胞抗原 (HLA) II 类分子呈递的抗原来促进或抑制抗肿瘤反应,但癌症如何利用这些生理过程来实现免疫逃避仍然未被了解。作者对浸润人类黑色素瘤标本的 CD4+ T 细胞的表型和肿瘤特异性进行了深入分析,发现耗尽细胞毒性的 CD4+ T 细胞可以通过识别 HLA II 类限制性新抗原被黑色素瘤细胞直接诱导,对HLA I 类限制性肿瘤相关抗原也是如此。CD4+ T 监管 (TReg) 细胞可以通过抗原呈递细胞呈递肿瘤抗原而间接诱发。值得注意的是,许多肿瘤反应性 CD4+ TReg克隆受到 HLA II 类阳性黑色素瘤的直接刺激,并显示出对黑色素瘤新抗原的特异性。这种现象是在存在极高肿瘤新抗原负荷的情况下观察到的,作者通过对 116 个黑色素瘤标本的分析证实这与 HLA II 类阳性有关。作者的数据揭示了黑色素瘤中浸润 CD4+ T 细胞的情况,并指出 HLA II 类限制性新抗原的出现和免疫抑制 CD4+ T Reg的直接参与细胞作为免疫逃避机制,在 HLA II 类阳性黑色素瘤中受到青睐。
背景介绍
抗原特异性 CD4+ T 细胞在适应性免疫中具有核心作用,因为它们可以作为 T 辅助细胞极化免疫反应,作为 T 滤泡辅助细胞 (TFH ) 协调体液反应,作为 TReg细胞,调节效应细胞的活性,或直接杀死目标细胞毒性T细胞。几项研究表明,CD4+ 肿瘤浸润淋巴细胞 (TIL) 在多种癌症中存在,并且它们可以在确定治疗结果中发挥作用。
虽然 CD4+ TILs 可以通过 T 细胞受体 (TCR) 与靶细胞上表达的肽-HLA II 类复合物的相互作用引发,但驱动它们在肿瘤微环境 (TME) 内激活的机制仍是未知的,尤其只有少数肿瘤高水平表达 HLA II 类分子。因此,CD4+ TILs 如何与肿瘤细胞相互作用以及可以引发细胞毒性或调节反应的肿瘤抗原的特性仍然知之甚少。
本文中,作者团队对 HLA II 类低或高表达的人类黑色素瘤的CD4+ TIL进行了单细胞表征,并使用 TCR 重建来揭示 CD4+ TIL 的肿瘤特异性。通过测试 TCR 对自体患者来源的黑色素瘤细胞系 (pdMel-CLs) 或负载肿瘤裂解物的抗原呈递细胞 (APCs) 的反应性,作者评估了 CD4+ TCRs 直接或间接识别肿瘤细胞的能力。因此,本文的研究能够明确地将抗肿瘤 CD4+ TIL 的表型和抗原特异性联系起来。
图文速读
CD4+ TIL TCR 克隆型的细胞状态
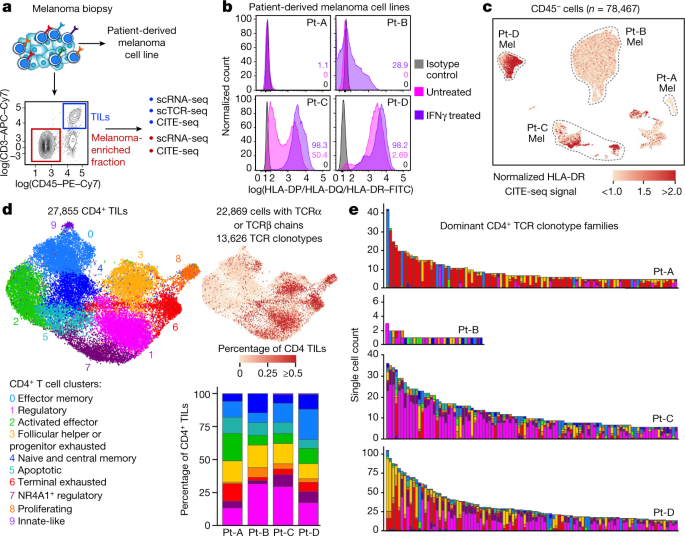
图1 CD4 + TIL TCR 克隆型的黑色素瘤 HLA II 类表达和表型。
a,黑色素瘤样本的处理和单细胞测序分析示意图。
b,与同种型对照(灰色)相比,在基础培养条件(洋红色)或暴露于 IFNγ 72 小时(紫色)下 4 个 pdMel-CL 中 HLA II 类表达的流式细胞术评估。
c ,从四名患者的黑色素瘤中分离出的富含肿瘤的 CD45 -细胞的 scRNA-seq 数据的统一流形逼近和投影 (UMAP) 。颜色表示由 CITE-seq 确定的表面 HLA-DR 表达。
d , 从 CD4+的 scRNA-seq 数据推断的细胞状态的 UMAPTIL。右图,同一 UMAP 上的 CD4+ TIL,注释了患者体内 TCR 克隆频率(由 scTCR-seq 定义)。右下角,来自四名患者的 CD4+ TIL 中的聚类频率。
e,来自四名患者的黑色素瘤的前 100 个 CD4+ TCR 克隆型家族的聚类分布。颜色表示细胞状态,如d所示。
CD4+ TIL TCR的肿瘤反应性
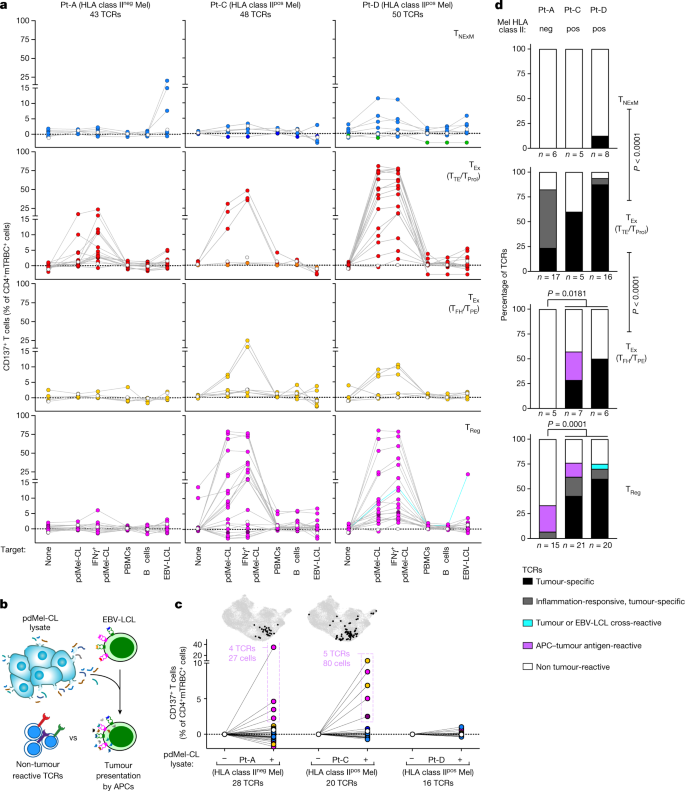
图2 CD4 + TIL 的 TCR 的肿瘤反应性。
a, CD4+ TIL 克隆的主要 TCR 与 TNExM、 TEx(分为 TTE /TProl和 TFH /TPE)或 TReg表型在三名黑色素瘤患者中的反应性。在单独培养的 TCR 转导的 (mTRBC+ ) CD4+ T 细胞(无靶标)或存在自体 pdMel-CL(有或无 IFNγ 预处理)或对照(PBMC、B 细胞或 EBV-LCLs)。减去不相关 TCR 的背景反应性(扩展数据图4b中的示例))。虚线表示单个 TCR 的行为;点颜色对应于图1d中显示的TCR克隆型的表型;空心点显示未转导细胞的信号,绿松石线显示肿瘤和 EBV-LCL-交叉反应性 TCR。
b,用于测试间接抗肿瘤反应性的工作流程:自体 APC (EBV-LCL) 用来自 pdMel-CL 的肿瘤裂解物进行脉冲处理,并用于攻击 64 个未表现出直接肿瘤识别的 TCR,如a(来自 Pt-A、Pt -C 和 Pt-D)。
c, TCR 对 APC 呈递的肿瘤抗原的反应性,测量为 CD137 的上调。PBS 脉冲目标用作背景对照。点颜色对应于图1d中所示的 TCR 克隆型的表型。在 CD4+ TIL(对应于图1c中的 UMAP )中追踪反应性 TCR(以紫色概述),以描绘相应 TCR 克隆型的丰度和簇分布(顶部,黑点)。
d,CD4+ TIL TCR 反应性的总结,如在a和c中测量的三名患者(Pt-A、Pt-C 和 Pt-D)。显示了四种不同 CD4 的 TCR 类别百分比+表型。x轴下方的标签显示测试 TCR 的数量。P双面 Fisher 精确检验在每个表型区室或 HLA II 类pos(Pt-C 和 Pt-D)与 HLA II 类阴性(Pt- )中测试的具有直接抗肿瘤活性(黑色或灰色)的 TCR 总数A) 黑色素瘤。
抗肿瘤 CD4+ TCR的特异性
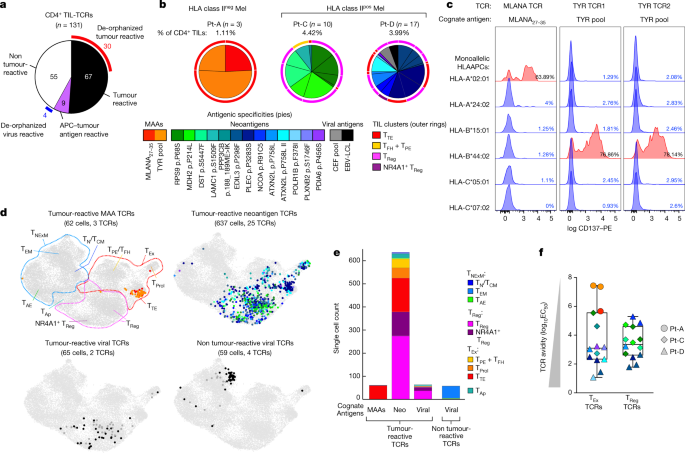
图3 CD4 + TIL 的 TCR 的抗原特异性。
a,饼图总结了 131 个 CD4+ TIL TCR 的分类,这些 TCR 在来自 3 名患者(Pt-A、Pt-C 和 Pt-D)的黑色素瘤中测试了抗原特异性。部分外环表示检测到抗原特异性的 TCR(即去孤立化)。
b,去孤立化抗肿瘤 TIL TCR 的同源抗原,显示具有 MAA、新抗原或病毒抗原特异性的 CD4+ TCR 克隆型的相对频率。CD4+ TIL 中测试的 TCR 克隆型的数量和总频率报告在每个图表上方。饼图颜色表示 TCR 的同源抗原;外环颜色显示克隆型的主要表型。
c,来自 Pt-A的 3 个去孤立化肿瘤特异性 CD4+ TCR 的 HLA I 类限制的去卷积。流式细胞术直方图描绘了用对 MLANA 27-35肽(n= 1,左)或 TYR 肽池(n = 2,右)有反应性的 TCR 转导的 CD4+ T 细胞上测量的 CD137 上调。用来自 Pt-A 的单个 HLA I 类等位基因稳定转化的 APC 呈递的 TCR 对其同源抗原进行了测试(行)。红色直方图显示 HLA I 类限制能够在同源抗原结合时触发 TCR 反应性。
d、CD4+的UMAPs带有对 MAA、新抗原或病毒抗原特异的抗肿瘤 TCR 或对病毒抗原特异的非肿瘤反应性 TCR 的 TIL。点颜色表示对应于b中方案的 TCR 抗原特异性。TIL 表型簇在第一个 UMAP 中作为参考进行描述。
e,对不同类型的同源抗原(MAA、新抗原和病毒抗原)特异的去孤立化肿瘤反应性或非肿瘤反应性 CD4+ TCR 克隆型的细胞计数。颜色显示细胞状态,由 scRNA-seq 推断(图1c)。
f,去孤立化抗肿瘤 TIL TCR 与 T Ex ( n = 14) 或 T Reg (n = 14) 表型。点颜色显示 TCR 同源抗原;配色方案如b。形状表示检测到 TCR 的患者。晶须从最小值延伸到最大值;水平条代表中位数,方框包含第 25-75 个百分位数。
HLA II 类pos黑色素瘤具有高 TMB
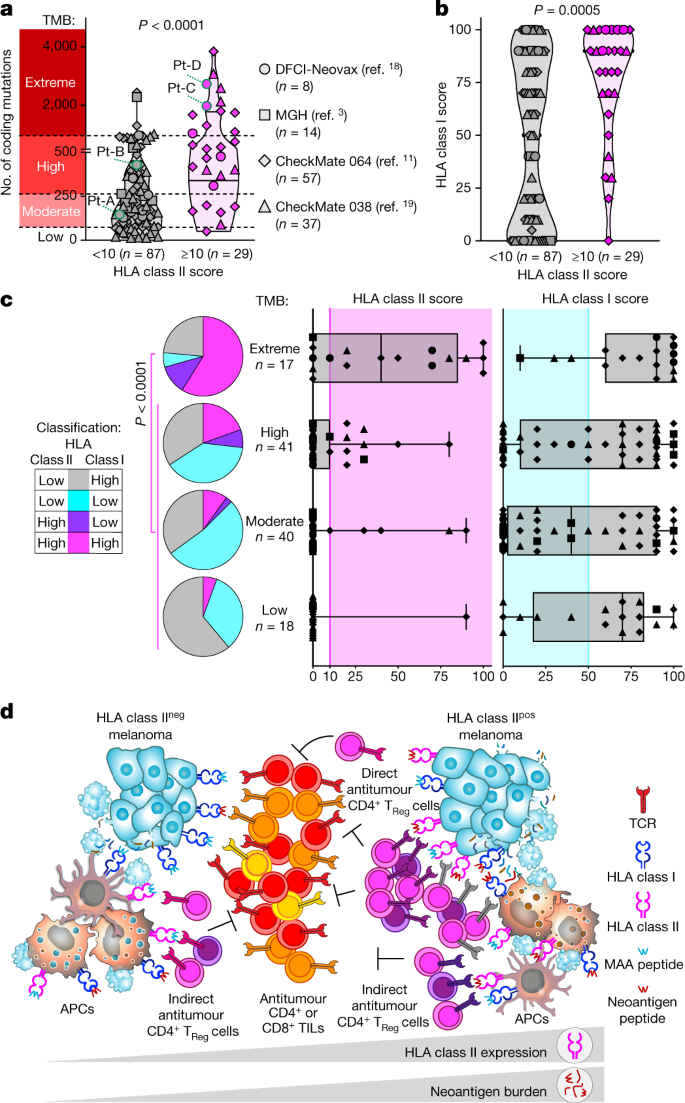
图4 黑色素瘤中 HLA 表达与突变负荷之间的关系。
a、b、编码突变的数量(来自肿瘤批量测序分析)
(a)和 HLA I类评分(来自 IHC)
(b)在之前四项研究的黑色素瘤患者中检测到;相同的形状代表整个图中的研究。根据 HLA II 类表达对黑色素瘤进行分类,通过 IHC 对肿瘤进行评分(≥10% 或 < 10% 的 SOX10+黑色素瘤细胞)。水平线代表中位数(粗体)和四分位数;P双边 Mann-Whitney 检验。
c,肿瘤 HLA I 类(顶部)和 HLA II 类(底部)评分由 IHC 确定的 116 个具有不同 TMB 范围的黑色素瘤标本,如a所示。粉红色区域表示 HLA II 类上调(IHC 分数 ≥ 10%),绿松石区域表示 HLA I 类下调(IHC 分数 ≤ 50%)。晶须延伸到最小值和最大值,水平条显示中位数,方框包含第 25-75 个百分位数。饼图显示了根据每个 TMB 类别的 HLA I 类和 II 类表达分类的黑色素瘤比例。HLA II 类pos富集的P值极端 TMB 组与非极端 TMB 组的病例(双边 Fisher 精确检验)。
d,HLA II 类驱动的黑色素瘤免疫逃避机制的提出:除了能够通过 APC间接引发 CD4+反应外,具有极端 TMB 的 HLA II 类pos黑色素瘤可以直接触发和扩大免疫抑制性 T Reg细胞克隆(描绘通过不同的 TCR 颜色)通过 HLA II 类新抗原复合物的暴露。
结论与展望
尽管已经在多种癌症的 TME 中描述了高频率的辅助性或调节性T细胞,但对于肿瘤如何与CD4+ TIL结合却知之甚少。在这里,作者通过将高分辨率单细胞分析与 CD4+ TIL TCR 的重建和特异性测试相结合,捕获了癌症和免疫细胞之间的潜在串扰。作者的数据描述了肿瘤特异性 CD4+ TIL 和黑色素瘤之间的三种一般类型的潜在相互作用。
首先,作者证实肿瘤特异性 CD4+ TIL TCR 可以通过 APC 呈递肿瘤抗原来参与,即使在没有肿瘤 HLA II 类表达的情况下也能诱导 CD4+反应。作者确定了这种肿瘤抗原呈递的间接途径主要引发了推定的免疫抑制性 T Reg细胞。因此,与其他免疫细胞配合,HLA II 类阴性肿瘤可以间接激活肿瘤特异性免疫抑制性 T Reg细胞。
第二类相互作用涉及肿瘤细胞直接参与 T Reg细胞,突出了异常表达 HLA II 类的黑色素瘤获得免疫逃避能力。我们明确地确定了超过 70% 的 TReg TCR 的直接肿瘤特异性,这些 TReg TCR 在两名患有 HLA II 类黑色素瘤患者的 TME 中得到扩展。大多数此类 TCR 对新抗原具有与 T Ex TCR相似的亲和力,表明它们的刺激可能导致推定的免疫抑制性 TReg的激活细胞。在 Pt-C 和 Pt-D 中,这种现象不仅有利于 HLA II 类的稳定肿瘤表达,而且还有极高的 TMB。事实上,在具有极端 TMB 的黑色素瘤中,HLA II 类表达高度富集,这在独立样本中得到了强有力的验证。作者假设这种关联将为功能性新抗原特异性T Reg细胞的克隆扩增提供基础,尽管这种效应的最终证明需要评估额外的 scRNA-seq 和 scTCR-seq 数据集,这些数据集具有检测大量 T Reg 所需的高深度。注册细胞并评估它们的克隆性和功能能力。事实上,CD4+克隆型的普遍低水平扩增和 HLA II 类pos的低频率具有极端 TMB ( 10 %) 的黑色素瘤限制了现有黑色素瘤数据集中的验证。尽管如此,来自 Pt-C 和 Pt-D 的数据表明,通过呈现大量新抗原,HLA II 类的表达允许黑色素瘤参与和控制推定的免疫抑制性新抗原特异性 TReg克隆,从而抵消高免疫原性,这将是否则会出现极度突变的肿瘤。正如对肿瘤细胞系的分析所表明的那样,作者怀疑异常的 HLA II 类表达在具有去分化神经嵴表型的黑色素瘤中特别丰富,其可能获得类似于在胎儿神经细胞中观察到的HLA II类pos SOX2 pos状态。
最后,CD4+ T Ex TIL 高度富集了肿瘤特异性 TCR,揭示了它们与肿瘤抗原的相互作用如何显著使细胞毒性 CD4+ T 细胞的表型向高度耗尽状态倾斜。此类 CD4+ TIL 可以由 HLA II 类限制性新抗原(如在 Pt-C 和 Pt-D 中)和 MAA 肽在 HLA I 类分子的背景下呈现时引发,如 Pt-A 中所证实的。这些 CD4+ TIL 具有不依赖 CD4 和 CD8 的 TCR,并显示出与抗肿瘤 CD8+ TIL 高度相似的表型和细胞毒性。需要进一步的研究来调查 HLA I 类限制性 CD4+的发生率TIL,但我们推测,当经典的 HLA II 类限制性 CD4+反应不受欢迎时,此类 TIL 更可能存在(如来自 Pt-A 的黑色素瘤,其 HLA II 类表达低)。
这项研究的重点是对未经治疗的黑色素瘤的深入表征。然而,HLA II 类表达与免疫检查点阻断后的总生存期和无进展生存期增加相关。事实上,我们发现 HLA II 类pos黑色素瘤不仅以 T Reg细胞的克隆扩增为特征,而且还以大量 CD8+ TIL 为特征,因为它们与极端 TMB 相关。在这种情况下,CD8+反应的恢复可能会破坏效应细胞和 T Reg细胞之间的平衡,从而促进 HLA II 类pos预期的高免疫原性。黑色素瘤。鉴于 TReg细胞直接或间接参与的重要性,作者的研究为开发可能破坏这种相互作用以提高免疫疗法(如癌症疫苗或免疫检查点阻断)的功效的疗法提供了基本原理。








暂无评论
发表评论