文章亮点
1. 在这项研究中,作者团队报告了argolaphos 膦肽的完整生物合成途径,揭示了氨甲基膦酸酯 (AMPn) 和 Nε-羟基精氨酸的生化来源。
2. 作者团队研究发现,这两种非典型氨基酸是 argolaphos 抗菌功能不可或缺的,对这一途径至关重要的是脱氢酶和转氨酶,它们致力于将羟甲基膦酸盐转化为 AMPn。
3. L-精氨酸和L-缬氨酸的顺序连接由两种GCN5相关的N-乙酰转移酶以tRNA依赖性方式提供,AglA 被发现是一种不寻常的血红素依赖性单加氧酶,它使 AMPn-Arg的 Nε位置羟基化。
4. AMPn 和 YqcI/YcgG 基因在放线菌基因组中的广泛分布表明它们参与多种代谢途径和细胞功能。
5.作者的研究结果阐明了天然产物生物合成的新范例,并实现了等待发现的大量 AmPn 和 Nε-羟基精氨酸天然产物。
背景介绍
膦酸盐和次膦酸盐 (Pn) 天然产物 (NPs) 是具有在医学和生物技术中应用历史的多种分子。通过对细胞代谢物的自然模拟和对碳-磷键水解降解的内在抗性,许多 Pn NPs 可作为代谢和信号转导中关键酶的有效抑制剂。
这些特性使其作为药物和除草剂的开发和商业化倍受青睐。值得注意的例子包括磷霉素,这是一种杀菌抗生素,可共价修饰 UDP-N-乙酰氨基葡萄糖烯醇丙酮酰转移酶 (MurA) 的活性位点半胱氨酸,以不可逆地阻断细菌细胞壁合成。几种农业除草剂中的活性成分是膦丝菌素。
作为谷氨酸的次膦酸盐类似物,膦丝菌素抑制谷氨酰胺合成酶以破坏氮稳态,引发氨基酸生物合成、光合作用和光呼吸途径的级联终止,最终导致植物死亡。有趣的是,一些生物合成中间体具有与抗病毒药物开发相关的特性。
羟甲基膦酸酯 (HMPn) 是膦丝菌素生物合成的中间体,存在于靶向逆转录酶(如替诺福韦)的抗病毒核苷前药的核心结构中。膦酸酯可抵抗细胞内的磷原子水解并减少所需的内源性磷酸化步骤的数量将替诺福韦完全激活为抑制性三磷酸核苷类似物。膦酰乙酸酯和膦酰甲酸酯都具有天然的抗病毒特性,后者作为膦甲酸被商业化用于治疗巨细胞病毒感染。Pn NPs 在药物发现方面的历史性成功,以及以下观察结果:7% 的微生物含有用于生物合成的基因,激发了人们重新努力增加我们对其天然化学多样性的理解。
事实上,基因组学驱动的发现活动(即基因组挖掘)已经开始扩展由编码未表征的生物合成基因簇(BGC)的微生物产生的 Pn NPs 的阵列。其中包括 NP 化学中的新化学型、以前未知的 Pn 头基和多种磷酸肽,其中许多具有抗菌、抗真菌或除草剂的特性。
这些研究验证了 Pn NP 基因组挖掘的有效性,但也强调了显着仅从序列信息准确预测生物合成途径和化合物的挑战。因此,建立抑制性化学部分生物合成的遗传和生化原则仍然是改进基因组挖掘的重要优先事项。
在这里,作者团队通过阐明最近发现的从单霉素链霉菌中分离的抗菌磷酸肽 argolaphos 的遗传和生化逻辑来加深我们对 Pn 代谢的理解。Argolaphos 是第一个含有氨基甲基膦酸盐 (AMPn) 和Nε-羟基精氨酸的 NP,这两种抑制性非蛋白质氨基酸具有神秘的生化起源(图 1A)。
AMPn是甘氨酸的 α-氨基膦酸盐模拟物,是合成神经活性剂 EAB-318、除草剂草甘膦的关键成分,并通过抑制丙氨酸消旋酶 D-Ala−D-Ala 连接酶破坏细菌细胞壁合成,和 UDP-N 乙酰胞壁酰-L-丙氨酸合成酶。Nε-羟基精氨酸是抗菌作用机制尚待描述 ,迄今为止已在其他抗菌 NP 肽 asterobactin、 三原霉素、 和五胺霉素(图 1A)中发现。抗菌活性和协同抑制与单独的 AMPn 相比。
在这里,作者团队推断了 argolaphos 的完整生物合成途径,argolaphos 是九种酶反应的产物,其基因编码在多个放线菌中存在的专用生物合成基因簇 (BGC) 中。AMPn 源自 Pn 代谢中的一个新分支点,其反应与用于丝氨酸生物合成的反应同源,表明这两种途径之间存在进化联系。
作者团队揭示了一种不寻常的含血红素单加氧酶的生物化学,该酶与先前表征的加氧酶家族不同,它负责 Nε-羟基精氨酸的形成。AMPn 和 Nε-羟基精氨酸在多个微生物类群中的广泛分布基因表明了这些生物合成机制的功能保守性,并阐明了编码具有这些抑制部分的 NPs 的未知 BGCs 的多样化。
图文速读
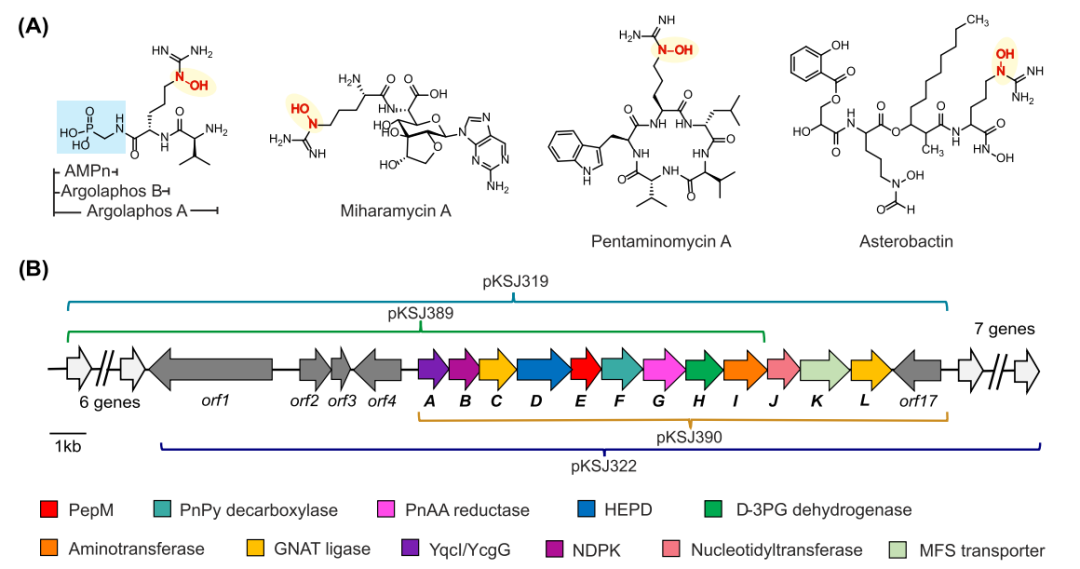
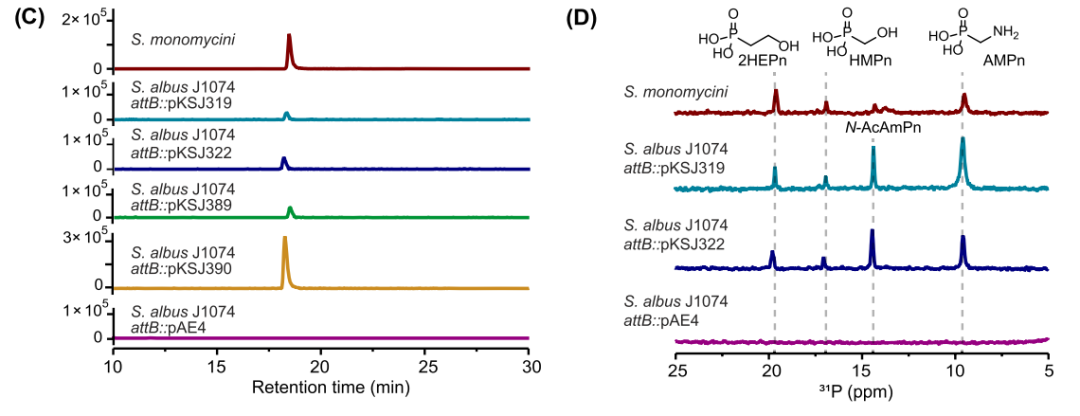
图1
(A) 含有 Nε-羟基精氨酸的天然产物。
(B) argolaphos 基因簇图 (NCBI 登录号 MZ612424)。在 fosmids 中克隆的区域用括号表示。PnPy:膦酰基丙酮酸,PnAA:膦酰基乙醛,HEPD:2HEPn 双加氧酶,NDPK:核苷二磷酸激酶。
(C) 从生产提取物中提取的 m/z 284.1118 [M + H]+ (argolaphos B) 的离子色谱图。S. monomycini 是原生生产者,Streptomyces albus J1074 attB::pAE4 是阴性整合对照。上面说明了由剩余菌株克隆和表达的 aglE 邻域。
(D) 生产提取物的 31P NMR 光谱。
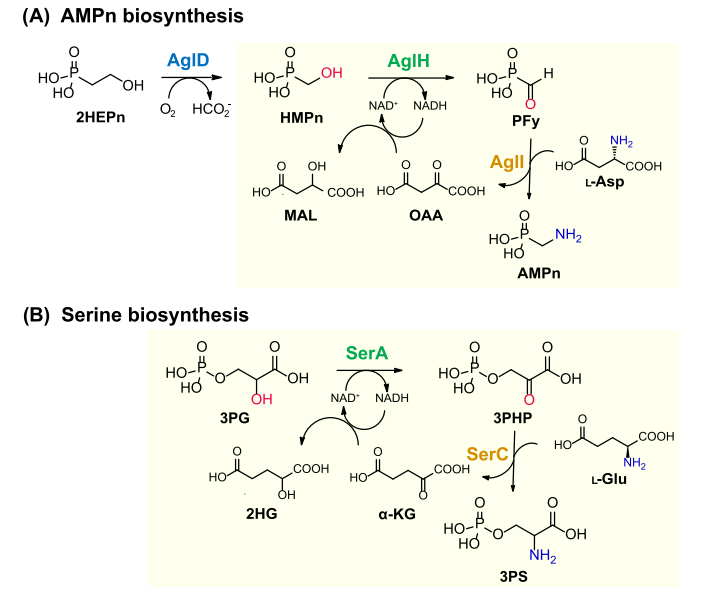
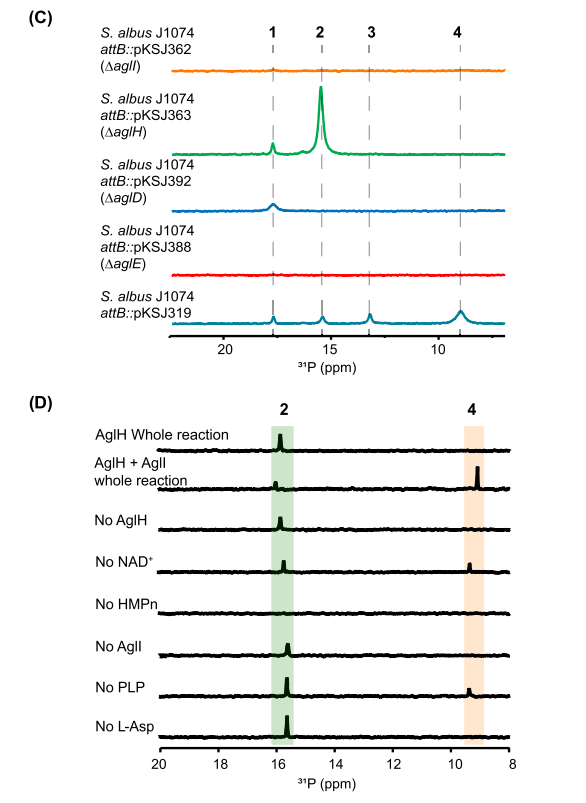
图2 2HEPn 到 AMPn 的转化。
(A) 2HEPn 到 AMPn 的拟议途径。
(B) 丝氨酸生物合成的初始步骤。
(C) 生产提取物的 31P NMR 光谱。
(D) AglH 和 AglI 体外测定的 31P NMR 光谱。AglH 整个反应含有 AglH、NAD+ 和 HMP。AglH 和 AglI 全反应分别包含 AglH、NAD+、HMPn 和 AglI、PLP、L-Asp。1:2HEPn,2:HMPn,3:N-乙酰-AMPn,4:AMPn。
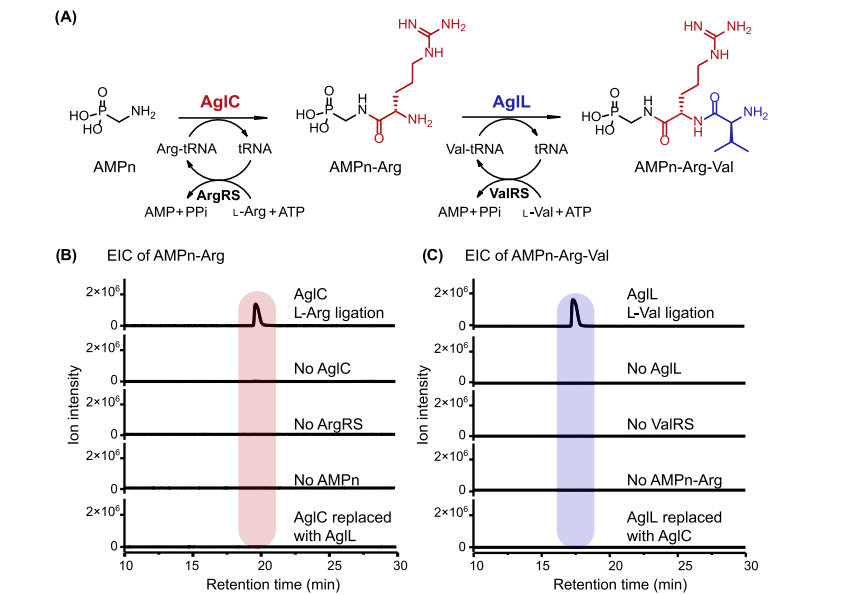
图3 氨基酸与 AMPn 的连接。
(A) AMPn 到 AMPn-Arg-Val 的拟议途径。
(B) 从 L-Arg 连接反应中提取的 m/z 268.1169 [M + H]+ (AMPn-Arg) 的离子色谱图。AglC L-Arg 连接反应含有 AglC、ArgRS、L-Arg、tRNA、ATP 和 AMPn。
(C) 从 L-Val 连接反应中提取的 m/z 367.1853 [M + H]+ (AMPn-Arg-Val) 的离子色谱图。AglL L-Val 连接反应包含 AglL、ValRS、L-Val、tRNA、ATP 和 AMPn-Arg。
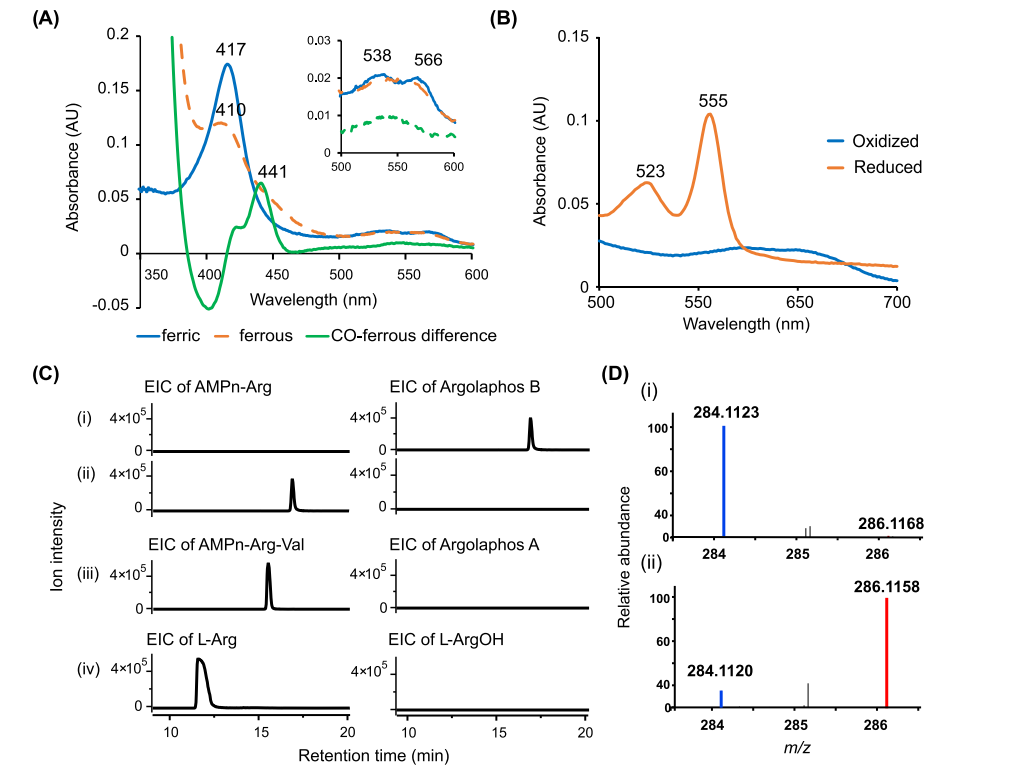
图4 AglA 的生化特征。
(A) 不同形式的 AglA 的紫外-可见光谱。蓝色:纯化后的(铁)。橙色:连二亚硫酸盐还原(亚铁)。绿色:连二亚硫酸盐还原的 CO 结合和连二亚硫酸盐还原的光谱差异。插图:500-600 nm 区域的扩展视图。
(B) AglA 的吡啶血色素原测定的紫外可见光谱,氧化与还原。
(C) LC-HRMS 分析含有 AglA、菠菜铁氧还蛋白、铁氧还蛋白还原酶和 NADPH 的生化反应。测定的底物包括 (i) AMPn-Arg 和 (ii) 没有 AglA 的阴性对照,(iii) AMPn-Arg-Val,和 (iv) L-Arg。底物的提取离子色谱图(AMPn-Arg,m/z 268.1169 [M + H]+;AMPn-Arg-Val,m/z 367.1853 [M + H]+;L-Arg,m/z 175.1190 [M + H] ]+) 和羟基化产物(argolaphos B,m/z 284.1118 [M + H]+;argolaphos A,m/z 383.1802 [M + H]+;L-ArgOH,m/z 191.1141 [M + H]+)显示。
(D) 在 (i) 标准与 (ii) 18O2 气氛中进行测定时 AglA 反应产物的 MS 光谱。掺入 16O 的 argolaphos B 离子(m/z 284.112 [M + H]+)以蓝色显示,掺入 18O 的离子(m/z 286.116 [M + 2 + H]+)以红色显示。
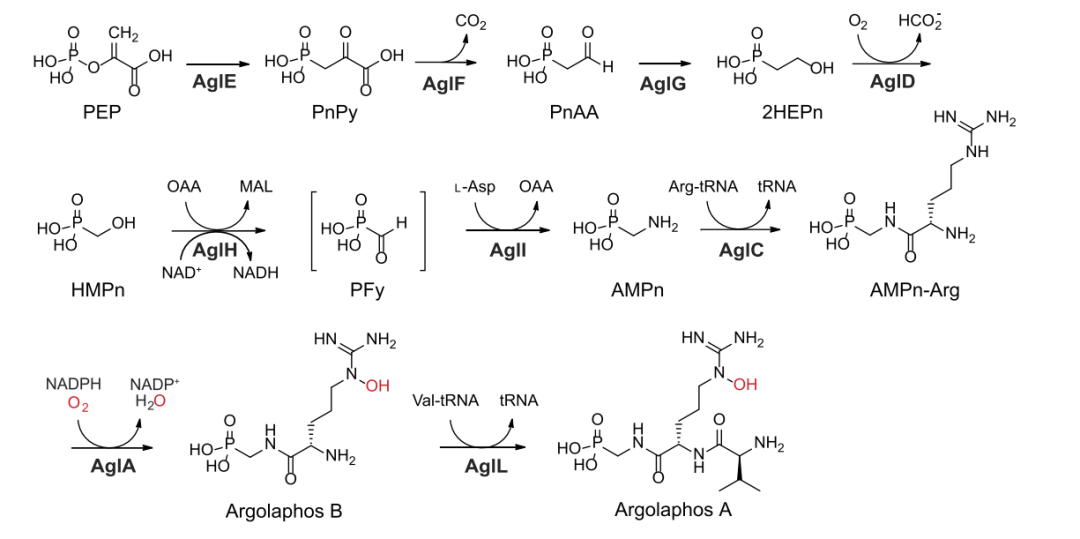
图 5 argolaphos 的生物合成途径。
结论与展望
总之,作者团队通过一系列比较基因组学、异源表达、基因缺失和生化重组实验建立了argolaphos的完整生物合成途径(图5)。在构成 BGC 的 12 个连续基因中,只有 9 个编码的酶是生物合成所必需的。
该途径以 PepM (AglE) 将 PEP 重排为 PnPy 以及 AglF 立即脱羧为 PnAA 并随后通过 AglG 还原为 2HEPn 开始。接下来,2HEPn 被 AglD 氧化裂解以产生 HMPn,同时失去甲酸盐。脱氢酶 AglH 将 HMPn 氧化为 PFy 与 AglI 的 PLP 依赖性转氨作用相结合,以提供 AMPn。
在 GNAT AglC 连接 Arg 后,AMPnH Arg 二肽被血红素依赖性单加氧酶 AglA 羟基化形成 argolaphos B。最后,GNAT AglL 连接 Val 以完成 argolaphos A 的生物合成。AglL 还将 Val 连接到 AMPn-Arg 形成非羟基化三肽。有趣的是,单霉素链球菌不仅产生 argolaphos A 和 B,而且还产生它们的非羟基化形式。
与单独的每种化合物相比,这种膦肽混合物可能表现出增强的抗微生物活性。AglC 和 AglL 添加到越来越多的用于磷酸肽生物合成的 tRNA 依赖性氨基酸连接酶。
GNAT 的不同催化特性反映在它们的底物和反应产物的化学差异上。了解它们的底物范围和特异性的分子决定因素将有助于对从 BGC 和 GNAT 编码的潜在 NP 肽及其作为生物催化剂生产天然或衍生化合物的潜在用途进行精确预测。AMPn 通路与先前表征的 Pn 生物合成通路建立了新的分叉,并有助于深入了解 HMPn 转化的生物化学。
AglH 和 AglI 的相互依赖的反应提供了一种热力学有利的解决方案,以促进 HMPn 的氧化,再生所需的 NAD+ 辅因子,并介导 PFy 的形成以避免潜在的毒性。这种机制可能是在膦丝菌素生物合成中 HMPn 向膦酰甲酸酯(通过 PFy)的拟议转化的基础。PhpE(AglH 的同源物)与醛脱氢酶 PhpJ 的生化偶联可能是克服类似的能量障碍以在体外成功重组所必需的。
AglH 和 AglI 的生化逻辑反映了丝氨酸生物合成的最初两个步骤,支持了以下假设:初级代谢是 NP 途径和酶的祖先起源。重要的是,几个放线菌基因组包含 AMPn 生物合成的基因。这些 BGCs 不仅表明具有这种抗菌部分的额外 NPs,而且还突出了微生物作为陆地和水环境中 AMPn 的潜在来源。
作者注意到长期以来在沉积物、地表水和地下水中检测到 AMPn。被解释为合成除草剂草甘膦(农达)或工业氨基多膦酸盐的人为应用造成环境污染的标志。鉴于生物合成途径在不同微生物之间的分布,作者建议在评估其在自然环境中的存在时额外考虑生物源 AMPn。
AglA 作为一种新的血红素依赖性单加氧酶催化精氨酸 Nε -羟基化的发现解决了微生物生物化学中两个悬而未决的问题:Nε-羟基精氨酸的起源和 YqcI/YcgG 蛋白的功能。虽然前者的客串外观可以在少数抗菌 NPs 中找到,但 YqcI/YcgG 蛋白的难以捉摸的功能可以追溯到它们在枯草芽孢杆菌基因组功能注释期间的原始鉴定。
作者建议将 AglA 作为 YqcI 的原型/YcgG 血红素加氧酶家族,其在微生物基因组中的大量丰度表明在 NPs 及其他方面具有多种功能。更广泛地说,作者在本研究中揭示的生物合成见解和酶突出了未来研究的几种不同寻常的生化转化,以及通过基因组挖掘实现的大量潜在的含有 AMPn-和 Nε-羟基精氨酸的天然产物。









暂无评论
发表评论