一、背景
近几十年来,先进癌症疗法的爆炸式增长,包括手术、化疗、放射疗法、基因疗法、光动力和光热疗法(PDT/PTT)和免疫治疗。其中,化疗作为一种有效的治疗技术已被广泛应用于临床。尽管在世界范围内取得了巨大的进展,但化疗仍存在严重的缺陷,如缺乏特异性和全身毒性。为了克服这些缺点,人们已经探索了一系列的策略,包括制造各种药物传递系统来装载化疗药物和构建刺激反应性可激活的前药物。虽然给药系统已经在实验室和临床中得到了广泛的研究和应用,但仍需进一步升级,以克服药物载药量低、药物过早泄漏和药物释放不足等问题。
前药是药物分子的衍生物,通过修饰活性位点来暂时阻断药物的活性,以减轻正常组织的毒性,提高生物利用度。目前,前药约占全球已上市药物的10%。当前药在肿瘤部位积累并被内源性刺激(如酶、还原环境、活性氧(ROS)、酸性和缺氧)或外源性刺激(如光和超声波)激活时,它们可以转化为活性形式以增强毒性。随着这些刺激,特别是外源性刺激的参与,前药激活过程可以与许多先进的治疗方法相结合,包括PDT和免疫治疗,以实现协同癌症治疗。
由于肿瘤组织的指令式激活,前药比母药表现出更高的特异性来提高化疗性能,从而导致更好的治疗效果和更少的副作用。大多数化疗药物的水溶性较差,由于其固有的疏水性,循环寿命较短。相比之下,前药往往表现出增强的水溶性。大分子前药的自组装或两亲性前药可以导致纳米颗粒,这不仅赋予化疗药物具有更好的药代动力学由于改善分散性,也增强药物积累功效在肿瘤组织增强渗透性和保留(EPR)效果。通过前药的形成,提高了药物的水溶性和体内循环时间,减轻了化疗的副作用,提高了其特异性和性能。
二、文献分析
1、手性 FA 共轭 CdTe/CdS 量子点用于选择性癌症消融

原文链接:
https://doi.org/10.1021/acsnano.2c05517
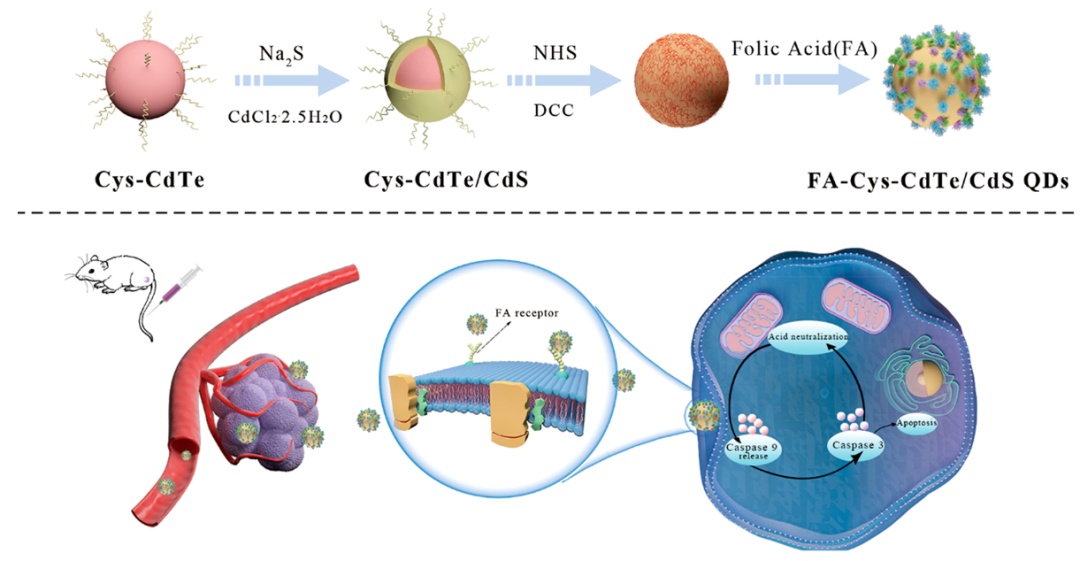
作者团队制造了与癌症靶向配体共轭的手性叶酸 (FA) 共轭 Cys-CdTe/CdS 量子点 (QD) 以诱导体内细胞凋亡。讨论了 FA-Cys-CdTe/CdS QDs 的配体诱导手性机制,并通过密度泛函理论 (DFT) 模拟进行了验证。有趣的是,作者发现手性量子点的圆二色性 (CD) 信号可以有效区分乳腺癌细胞和正常细胞,其中可以看到 CD 信号和吸收强度的急剧下降。值得注意的是,手性 FA-CysCdTe/CdS 量子点在线粒体凋亡因子释放后表现出显着的凋亡诱导能力。此外,体内实验表明,手性 FA-Cys-CdTe/CdS 量子点可通过细胞凋亡过程提供有效的癌症消融,且毒性可忽略不计,这表明它们在靶向抗癌剂中具有巨大的潜力,可用于未来的临床应用。
2、用于癌症治疗的刺激响应前药纳米系统中的新兴策略

原文链接:
https://doi.org/10.1021/acsnano.2c05379
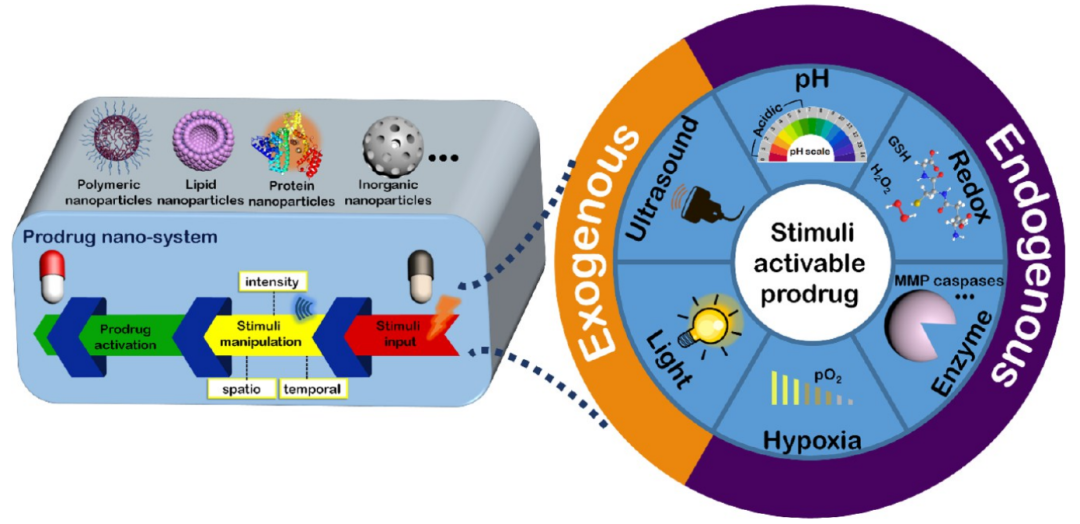
前药是化学修饰的药物分子,在给药前是无活性的。给药后,它们被原位转化为母体药物并诱导作用机制。前药的发展在生物利用度,靶向性和减少副作用方面升级了常规药物治疗。特别是在癌症治疗中,前药的应用取得了实质性的治疗效果。从早期的偶然发现到如今具有针对性的功能设计,前药在药物设计中的重要性不言而喻。目前,研究刺激反应激活机制,调节体内刺激强度,设计纳米前药制剂是促进前药发展的主要策略。在这篇综述中,作者团队从这三个方面对刺激响应性前药纳米系统的最新前沿研究进行了展望,并且讨论了此类前药未来发展的前景和挑战。
3、具有多种功能的套索状自组装抗癌肽的计算机辅助设计,用于靶向自我递送和癌症治疗

原文链接:
https://doi.org/10.1021/acsnano.2c01014
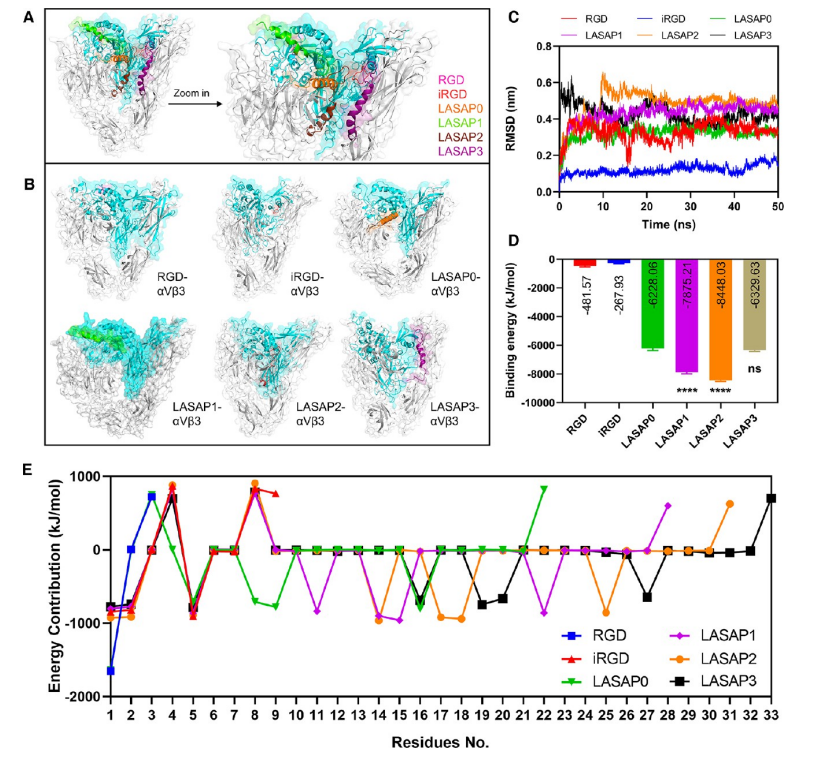
抗癌肽是治疗癌症的有希望的候选药物,但循环时间短和递送效率低限制了其临床应用。在此,作者团队通过计算机辅助方法设计了几种集成了多种功能的类套索自组装抗癌肽 (LASAPs)。在这些LASAPs中,LASAP1(CRGDKGPDCGKAFRRFLGALFKALSHLL,1-9二硫键) 被确定为优于其他LASAP1,因为它可以自组装成均匀的纳米颗粒并在血清中表现出改善的稳定性。因此,作者选择LASAP1来证明设计思想。LASAP1由于其两亲性结构而可以自组装成在表面显示iRGD的纳米颗粒,并由于EPR效应和iRGD靶向 αVβ3整联蛋白而在注射后积聚到肿瘤部位。纳米颗粒可以在实体瘤的酸性微环境中分解,并被前列腺肿瘤细胞分泌的过表达的hK2裂解,以释放效应肽PTP-7b (FLGALFKALSHLL),该肽被酸性pH进一步激活。因此,LASAP1可以靶向腹腔注射后的模型小鼠原位前列腺肿瘤,特异性抑制肿瘤生长,系统毒性低。结合多种靶向功能,LASAP1代表了用于靶向癌症治疗的多肽药物自我递送的有前途的设计。
4、奥希替尼-全氟化碳纳米乳在非小细胞肺癌中具有出色的靶向治疗效果: 实现气管内和静脉内给药
原文链接:
https://doi.org/10.1021/acsnano.2c04159
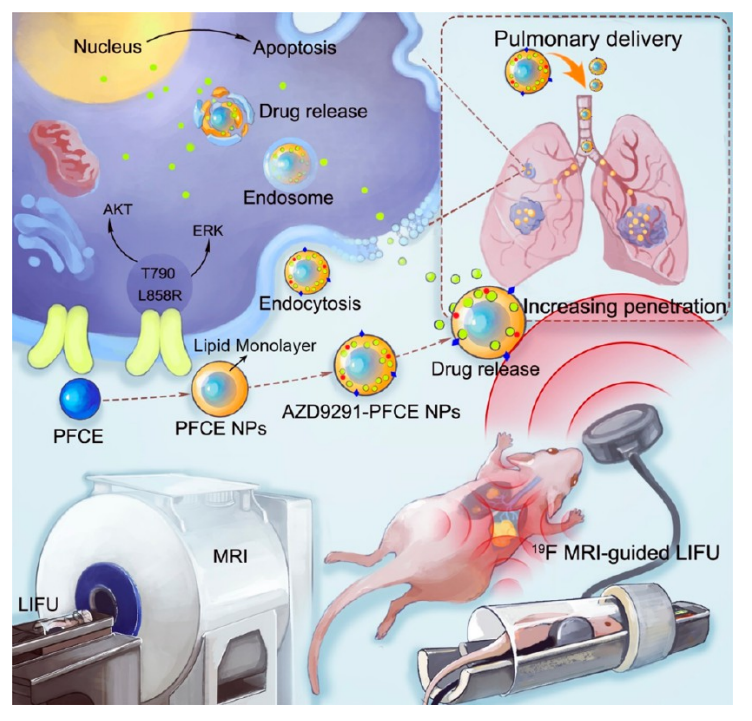
作者团队报告了一种负载奥希替尼的全氟-15-冠-5醚( (AZD9291-PFCE) 纳米乳剂,通过气管内和静脉内递送,与19F磁共振成像 (19F MRI) 引导的低强度聚焦超声 (LIFU) 协同用于肺癌治疗。AZD9291-PFCE纳米乳剂在原位肺癌模型中的肺递送可实现纳米乳剂在肺组织和肿瘤中的快速分布,而没有短期和长期的毒性作用。此外,LIFU可以触发药物从AZD9291-PFCE纳米乳剂中释放,并特异性地增加肿瘤血管和肿瘤组织的通透性。应用19F MRI实时定量利福照射后肿瘤中纳米乳的积累。作者验证了AZD9291-PFCE纳米乳剂在切除的人肺癌组织中的治疗效果,证明了提高肺癌治疗临床结果的转化潜力。因此,作者的这项工作提出了一种有前途的奥希替尼 (AZD9291) 肺纳米乳递送系统,用于肺癌的靶向治疗,而没有严重的副作用。
5、利用ZIF-8纳米反应器的超声激活,肿瘤特异性原位合成化学治疗剂,用于精确的癌症治疗

原文链接:
https://doi.org/10.1021/acsnano.2c03587
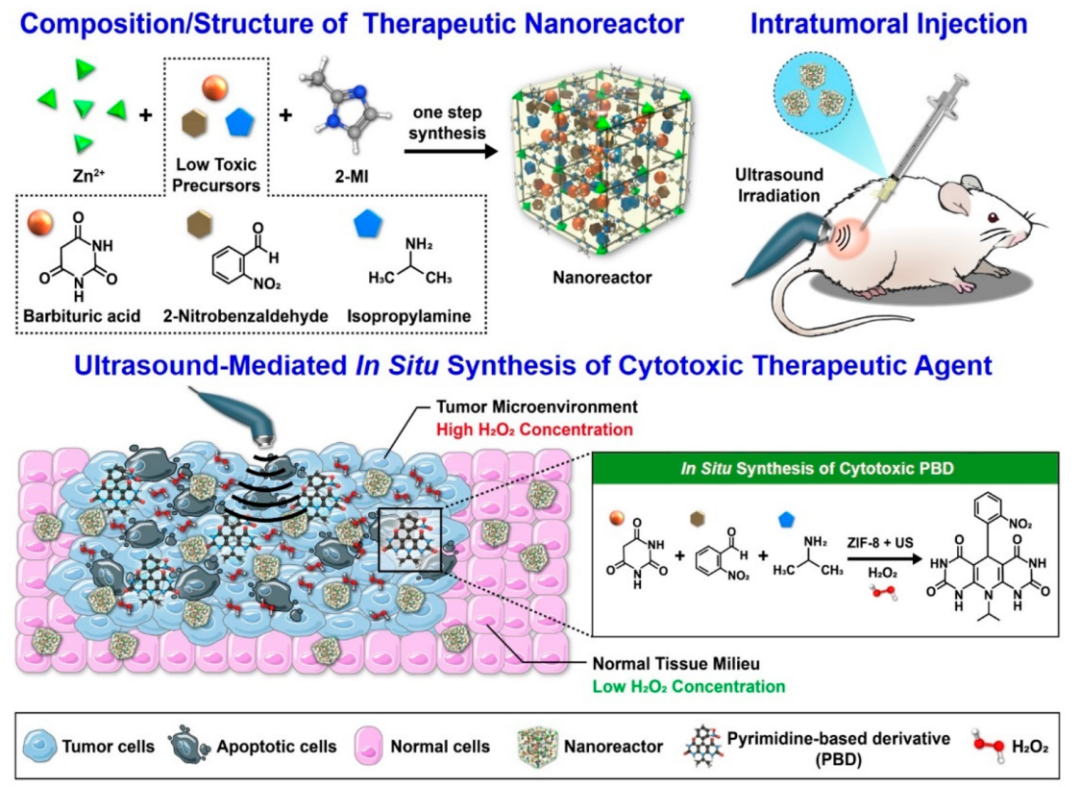
长期以来,将低毒性前体在肿瘤部位原位转化为化学治疗剂以增强其治疗功效一直是一个难以捉摸的目标。在这项工作中,作者团队制备了一种结合了药学上可接受的前体的锌基沸石咪唑盐框架,作为纳米反应器 (NR) 系统,用于抗肿瘤药物的局部合成。制备的NRs在荷瘤小鼠模型中瘤内给药,然后用超声波 (US) 照射以激活化学合成。尽管某些NRs泄漏到周围的正常组织中,但促进了所施用的NRs渗透到肿瘤组织中以完全覆盖病变。然而,只有H2O2浓度高的肿瘤组织才充分暴露于合成的抗肿瘤药物,这显着阻碍了肿瘤的发展。在周围正常组织中未检测到明显的化学合成,其中局部H2O2浓度可忽略不计,并且未直接施加US辐射。作者团队所提出的治疗分子的肿瘤特异性原位合成几乎不会引起任何明显的体内毒性,因此可能是精确化学疗法的有效生物相容性方法。







暂无评论
发表评论