一、前言
不对称催化是指在少量不对称催化剂的诱导下,高效率的获得对映体富集产物的不对称合成反应。其核心是手性催化剂。不对称催化由于其独特的优势成为手性合成中极具吸引力和最富挑战性的研究方向,过去几十年里吸引了很多优秀的科学家投身这一领域。其中三位科学家诺尔斯、野依良冶和夏普莱斯因为在该领域里的开创性工作分享了2001年诺贝尔化学奖。时隔20年,2021年诺贝尔化学奖再次“花落不对称催化”。本杰明·李斯特和大卫·麦克米伦因在不对称有机催化方面的研究被授予2021年诺贝尔化学奖。这一领域表现出光明的前景。本文选择了最近发表在nature上面的五篇研究论文对该领域的前沿工作进行了简要的介绍。
二、文献分析
1. 小酮的有机催化立体选择性氰基化反应

酶立体选择性通常是大多数化学催化剂无法比拟的,尤其是在小底物的转化中。根据“锁和钥匙理论”,酶具有有限的活性位点以适应其特定的反应底物,这是化学催化剂通常不具备的特征。在这方面,一个有趣的例子是酮和HCN生成氰基醇,因为这个反应可以由各种类型的催化剂催化,包括生物、无机和有机催化剂。作者报道了广泛应用于芳香和脂肪族酮的高度对映选择性氰基硅化反应的有机催化剂的发展,包括具有挑战性的2-丁酮。在这项工作中,对其药学相关产品获得的选择性(98:2 对映体比 (e.r.))是任何其他类型的催化剂(包括工程生物催化剂)无法比拟的(见图1)。研究结果表明,在转化小的底物方面,可以设计出与酶一样具有选择性的化学催化剂。
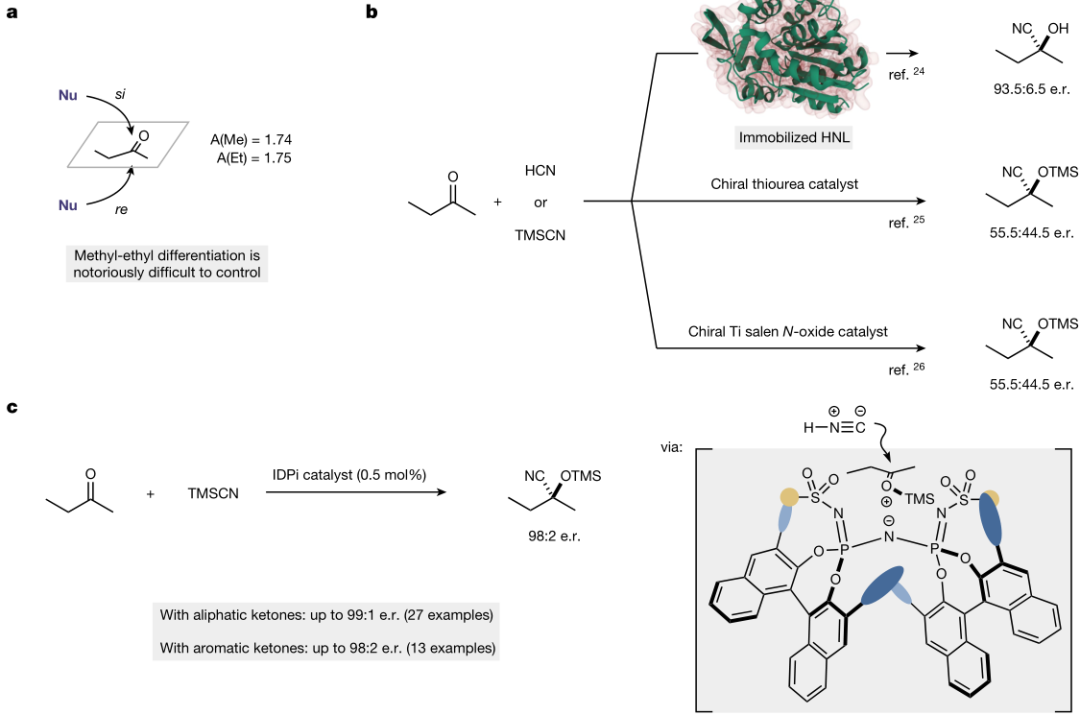
图1. 羰基化合物的催化不对称氰基化。
a、2-丁酮的对映面分化。
b、先前报道了2-丁酮与酶、有机催化剂和过渡金属催化剂的不对称氰化反应。
c、这项工作:IDPi催化2-丁酮和其他酮的高度对映选择性甲硅腈化反应。
原文链接:https://doi.org/10.1038/s41586-022-04531-5
2. 通过不对称缩合反应合成手性亚磺酸酯

非手性硫官能团,如磺酰胺、砜、硫醇和硫醚,在药物和天然产物中很常见。相比之下,手性硫官能团通常被忽略。最近,手性硫化物(sulfoximine)因其独特的物理化学和药代动力学性质被纳入若干临床候选药物中。因此,其他硫立体生成中心如亚磺酸酯、亚砜酰胺、磺胺酯和磺胺酰胺开始引起人们的关注。这些硫立体生成中心的多样性和复杂性有可能扩大药物发现的化学空间。然而,将这些结构对映选择性地安装到药物分子中是极具挑战性的。
作者报告了通过使用pentanidium作为有机催化剂,通过前手性亚磺酸盐和醇的不对称缩合直接获得对映体富集的手性亚磺酸酯。这项工作成功地、立体选择性地偶联了多种亚磺酸盐和生物活性醇(见图2)。初始亚磺酸盐可由现有的砜和磺酰胺类药物制备,生成的亚磺酸盐酯可转化为多种手性硫药效团。通过塞来昔布(celecoxib)和其他药物衍生物的后期多样化,作者证明了这种统一方法对硫立体中心的可行性。

图2. 用于药物发现和合成的多种手性硫药效团。
a、 含有S(IV)和S(VI)立体生成中心的生物活性化合物的实例。
b、 用于药物设计和发现的多种手性硫药效团的实例。
c、 手性胺催化剂动态动力学拆分合成手性亚磺酸酯。
d、 通过亚磺酸盐和醇的不对称缩合合成手性亚磺酸盐酯(作者的工作)。
原文链接:https://doi.org/10.1038/s41586-022-04524-4
3. 通过配体协同作用光诱导铜催化不对称酰胺化

用亲核试剂取代烷基亲电试剂是有机化学中的一个基础反应,它能够有效地合成有机分子。最近在利用过渡金属催化将亲核取代反应取得了实质性进展,但在与氮亲核试剂的相应反应方面进展有限。对于许多取代反应,键结构本身并不是唯一的挑战,因为同时需要控制立体化学。作者描述了一种通过普遍存在的含氮官能团酰胺对未活化的外消旋烷基亲电试剂进行对映收敛取代的方法。
这项工作的方法使用基于地球上丰富的金属铜的光诱导催化剂系统。这种不对称N-烷基化过程依赖于三种不同的配体——双膦、酚盐和手性二胺。配体在原位组装形成两种不同的协同作用的催化剂:用作光催化剂的铜/双膦/酚盐络合物,以及催化对映选择性C-N键形成的手性铜/二胺络合物。因此,这项研究将烷基亲电试剂的对映选择性N取代扩展到活化的亲电试剂(在进行取代的碳上具有至少一个 sp或 sp2杂化取代基的那些),包括未活化的亲电试剂。
原文链接:https://doi.org/10.1038/s41586-021-03730-w
4. 光酶对映选择性分子间自由基加氢烷基化

越来越多地探索酶用于不对称合成,但它们的应用通常受到天然酶可用反应的限制。最近,对光催化的兴趣激发了对已知酶的新反应性的发现。然而,到目前为止,光诱导酶催化尚未用于两个分子的交叉偶联。例如,烯烃与α-卤代羰基化合物通过可见光诱导的自由基加氢烷基化进行分子间偶联,这可以提供获得重要的 γ-手性羰基化合物的途径,但酶催化尚未实现。主要挑战是酶固有的较差的光反应性以及难以实现远程前手性自由基中间体的立体化学控制。
作者报告了末端烯烃的可见光诱导的分子间自由基加氢烷基化,这种反应由“烯”还原酶催化,使用容易获得的α-卤代羰基化合物作为反应物。该方法为合成各种带有γ-立体中心的羰基化合物提供了一种有效的方法,具有优异的产率和对映选择性(高达 99% 的产率和 99% 的对映体过量),否则使用化学催化很难获得这些化合物。机理研究表明,底物(α-卤代羰基化合物)和“烯”还原酶的复合物的形成触发了对映选择性光诱导自由基反应。这项工作通过光催化和酶催化的结合进一步扩展了生物催化、不对称转化的反应能力。
原文链接:https://doi.org/10.1038/s41586-020-2406-6
5. 筛选不对称催化的一般性

过去半个世纪以来,不对称催化领域的研究取得了里程碑式的进展,使手性构件、药物和天然产物的有效合成成为可能。已经确定了少数不对称催化反应,它们在广泛的底物范围内表现出高选择性。这些反应对如何合成对映体富集的化合物?作者认为不对称催化中的底物普遍性很少见,不仅因为它本质上难以实现,还因为手性催化剂的识别和优化方式。典型的发现活动依赖于单一模型底物,因此在狭窄的化学空间区域中选择高性能。
作者提出了一种实用的方法,从一开始就使用多个模型底物同时选择不对称催化反应中的对映选择性和通用性。多底物筛选是通过超临界流体色谱-质谱 (SFC-MS) 对混合样品进行高通量手性分析来实现的。当应用于 Pictet-Spengler 反应时,多底物筛选方法揭示了这一重要转化的一般对映选择性催化的有希望和意想不到的领先优势,甚至对筛选集之外的底物组合表现出高对映选择性。
原文链接:https://doi.org/10.1038/s41586-022-05263-2









暂无评论
发表评论