1 我们就是原子
在乐高的世界里,无论是高楼耸立的城市、马路上奔驰的汽车,还是华丽的城堡、精美的艺术品,构成乐高世界的最基本的元素就是积木。在真实世界中,同样存在着组成各种各样物质的最基本的元素—原子,就是我们今天要介绍的主角。其实,从一粒小小的尘埃,到森林山川峡谷再到宇宙星辰,都是由原子组成的,也可以说,我们眼前所处的这个世界上任何一种物体,包括我们自己,无一例外都是由原子构成的。我们时刻都在同原子保持着联络,我们就是原子世界的一部分。

图1.乐高积木(图源自网络)
当大多数人们还在沉醉于宏观世界的美丽风景时,已经有一小部分充满智慧的哲学家和科学家开始注意到由一个个小小的原子碰撞而成的微观世界了。那么,人们是如何发现原子的呢?
2 猜出个原子来
在当时连自行车都没有的年代,人们手里更不可能有精密的仪器帮助我们看到原子,到底是如何发现原子的,难道是靠猜吗?没错,发现原子就是猜的,科学有时候并不是一本正经,里面也有很多离奇的和偶然的事件,比如今天所说的猜出个原子。其实,关于世界上物质的组成和结构算是一个很古老的话题了,最早是哲学家对这一问题产生了兴趣。时间回到公元前5世纪,墨翟提出了“端,体之无序最前者也。”的观点,墨翟是我国著名的哲学家。墨翟所提到的端,就是指构成物质的最小单元,类似于我们今天说的原子。[1]古希腊的留基伯和德谟克利特两位哲学家也提出了原子学说,认为如果将世界万物不断分割,分到不能再分,最后的那个最小粒子就是原子,原子在世界上是永恒的,不会消失,不会毁灭。[2]

图2.古希腊德谟克利特的原子观(图源自网络)
历史经历了漫长的发展来到18世纪,科学家更多的还是凭借想象力来描绘原子的形象,并没有形成统一科学的理论体系,也难以应用“想象”的原子解释一些宏观世界的化学现象和变化规律,但是在当时,原子论还是深入人心。就在大家都深信不疑的时候,聪明睿智的道尔顿先生带着他的近代科学原子论登场了,为“黑暗”中的原子世界带来一丝光亮,道尔顿又是何许人也?
3 道尔顿与原子的初相识
下面我们简单介绍一下道尔顿先生。道尔顿是来自英国的著名化学家,出生在英格兰北部的一个织工家庭。道尔顿的家庭并不富裕,兄弟姐妹众多,读完小学后的道尔顿不得不被迫中途辍学,12岁开始,道尔顿就依靠自学,开启了漫漫的成才之路。[3]虽然生活上清贫,但是道尔顿勤奋自学,始终保持对知识的渴望与热情,在求学路上,道尔顿始终坚持“午夜方眠,黎明即起”,毫不松懈。幸运的是,道尔顿在自主求学的道路上遇到了很多良师益友,加上道尔顿本身对科学的热爱和兴趣,使道尔顿在充满荆棘泥泞的科学道路上不断前进,命运回馈给道尔顿的是他在科学上的那段光辉岁月。1803年,道尔顿创立了科学的原子论,使物质结构不再是困扰人们的千年迷雾,为物质结构的研究找到了突破口,为化学科学的发展开辟出一条光明的道路。[3]道尔顿将科学原子论的内容和研究历程写进著作《化学哲学新体系》中,上册在1808年出版,下册在1810年出版。[3]

图3.英国化学家、物理学家道尔顿(图源自网络)
我想你一定好奇道尔顿究竟是如何提出科学的原子论的呢?
道尔顿最初的兴趣是研究气象,在这期间,勤奋好学的道尔顿坚持写气象日记57年从未间断,正是由于道尔顿日复一日对大气现象的观察,道尔顿渐渐开始了他的科学研究之旅。[3]通过对气体的研究,善于思考的道尔顿很快就总结出气体分压定律:混合气体的压力与各组分气体在相同的条件下单独占有该容器时的压力之和相等。这一定律表明加入其他气体不会影响某一气体在容器中的存在状态。关于解释这样的实验事实,道尔顿还做过氢氧燃烧实验,发现1克氢气和7克氧气燃烧后,能得到8克水。随后道尔顿又多加了些氧气,让1克氢气和更多的氧气燃烧,结果呢?还是得到8克水!这样的结果说明了什么呢?
道尔顿当时猜想:能和1克氢气反应的氧气的量是确定的,即1克氢气只能和7克氧气发生反应,而多余的氧气只能“原封不动”地保留在气罩里。这就是加再多的氧气,也只能得到8克水的原因所在了。
道尔顿进一步分析猜想,气体看着是一坨一坨的,里面可能是一粒一粒的,如果真是这样,道尔顿将这些更小的一粒一粒的东西叫作原子。道尔顿是选择古希腊哲学中原子一词来称呼这些微粒,因为道尔顿认为没有哪一个词语更能体现原子的不可再分的性质,道尔顿用实验证实了原子是客观存在的。
实际情况应该是1克氢气加8克氧气,得到9克水,氢气和氧气按照2比1的比例消耗生成水:2H2+O2=2H2O。但是由于当时道尔顿太过贫穷,实验设备都是凑合买的,也有很多是自制的,所以实验误差比较大。导致在后面继续推断具体有几个氢、氧原子发生反应时,道尔顿还错误地认为水是HO,实际是H2O,但是整体思路是正确的。
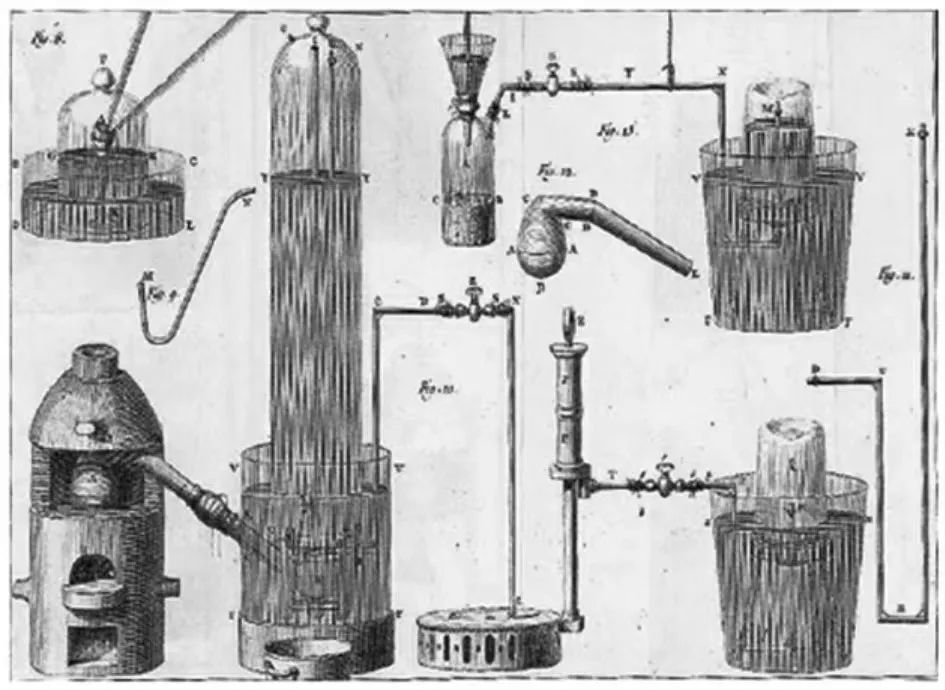
图4.十九世纪定量化学实验仪器(图源自网络)
但是道尔顿并没有止步于此,而是继续思考,现在已经知道原子确实存在,那么如何用原子理论来解释物质的性质和变化规律呢?仅仅研究气象学貌似无法解决这个问题,于是道尔顿把研究领域拓展到化学,开启了对化学世界的探索。
4 伟大发现
当时有个叫戴维的化学家,每天致力于研究氮气和氧气的各种花式反应,他发现:氮气和不同质量的氧气能反应变成5种不同的产物。假设氮气是质量1,那么氧气的质量有5种,分别是0.571、1.142、1.713、2.284、2.855,巧了,每种都比前面多出0.571,这是巧合吗?该如何解释?这个时候,聪明睿智的道尔顿专门写了一篇论文解释这个问题,氮氧原子的反应就好像成团组队,个数不同而已,其实这5种产物分别是N2O、NO、N2O3、NO2、N2O5,这样相当于每个组合都多了一个氧原子,就对上那0.571了。

图5.氮氧原子组合图
像这种情况还有很多,比如一些碳氢化合物,甲烷(CH4)和乙烯(C2H4)两种气体,假设两种气体中碳的质量都是1,甲烷中氢质量刚好是乙烯中氢质量的2倍。再比如,一氧化碳(CO)和二氧化碳(CO2)中,后者的氧的质量也刚好是前者的倍数。事出太巧必有妖,经过深思熟虑后,道尔顿总结出了一个重要的定律,甲乙两种物质相互反应生成几种不同的化合物,在这些化合物中含有相同的两种元素,其中一种元素的质量一定时,另一种元素的质量或个数互成简单整数比,叫做倍比定律。[3]道尔顿敏锐地意识到原子论的观点和倍比定律之间的关系,原子论能完美地解释倍比定律,倍比定律也是原子论的重要证据之一。
说到这里,你以为研究就要接近尾声了吗?远远没有,道尔顿又提出了关键性的问题:是否所有的原子都相同,具有同样的重量和体积呢?用什么办法测定原子的重量与大小呢?在大部分人还在为吃饭发愁的年代,有称猪肉的秤就不错了,要称出原子的质量,是不可能的。伟大的道尔顿先生并没有被困难击退,既然直接称不出,可以间接称啊。就像一只小鸡的体重是1,而母鸡是小鸡的10倍重,那么母鸡的重量自然而然就是10了,其实同样的道理,称量原子的质量关键也是找到两种原子质量之间的倍数关系,找到化合物中最轻的原子的质量,这个难题就迎刃而解了。没错,称量原子的重量,用的就是相对质量。
道尔顿随后以极大的热情投入到科学探究中,发现氢原子的质量是最轻的,就把氢原子的相对质量设为1,按照同样的思路,道尔顿测算了不同原子的相对重量,并写下了历史上第一张原子相对质量表。由于当时道尔顿的实验操作技术并不高超,很多实验仪器也比较简单,道尔顿本身也有色盲缺陷,导致道尔顿先生测定的原子量存在较大误差,但是这不是重点,重点是原子量作为一个新概念引入化学,使化学从此走上了定量的发展阶段。道尔顿是运用原子理论来揭示化学变化奥秘的第一人,使化学的发展不再局限于收集材料,而是走上了整理材料的新道路,为我们在科学世界中构建起一座原子大厦,现在大家尊称道尔顿为近代化学之父。
5 看见原子
这就是道尔顿与原子的神奇邂逅,在那个一穷二白的年代,道尔顿凭借丰富的想象结合严密的理论思维和实验的积累,提出科学的原子论,解释了当时的质量守恒定律、当量定律、定比定律,这些定律都属于经验规律,并在此基础上提出并证实了倍比定律,开创了用原子论的观点重新审视整个化学的新局面,这毋庸置疑是科学发展史上的一项伟业。现在随着科技的发展,人们通过扫描隧道显微镜可以看到原子,利用质谱仪可以测量原子的质量。
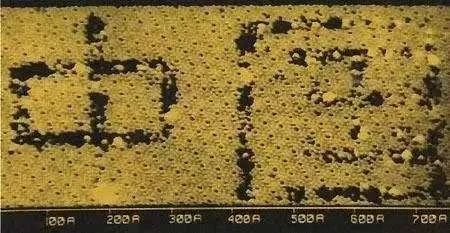
图6.扫描隧道显微镜下硅原子构成的文字(图源自网络)
当然,由于社会时代和道尔顿自身的局限性,原子论并不是完美的科学理论,也是有缺陷的,比如道尔顿认为原子不可再分,保持了古希腊的原子论观点;认为化合物是复杂原子,不懂得分子的概念。任何科学的发展都不是一帆风顺的,科学的发展永远是在曲折中前进,在继承中创新。原子的故事更像是一个传奇,原子论的提出仅仅是一个线索,曲径通幽,一股神奇的力量始终吸引着人们去探索原子内部的世界,当然原子小到无法用肉眼看见,但这丝毫不会影响科学家们探索未知世界的热情,伟大的科学家们总是能够在山穷水尽处踏出一条柳暗花明的道路,继续书写原子的壮丽诗篇。








暂无评论
发表评论