Q1 研究背景
DNA 损伤被认为是电离辐射和多种化学试剂的细胞毒性作用的原因。在不同形式的 DNA 损伤中,单链断裂和修饰的核苷酸被认为比双链断裂和 DNA-DNA 和 DNA-蛋白质交联的危害更小。然而,有几个最初形成的例子经历进一步生化影响反应的 DNA 修饰(损伤)。一些损伤会抑制负责维持基因组完整性的修复酶,而其他损伤会自发产生更有害的受损 DNA 形式,或者通过修复酶转化为此类产物。
这些观察表明,最初形成的 DNA 损伤可能只是开始的细胞毒性过程和更有害的后果可能发生在下游。在这里,作者报告了由这些蛋白质和 DNA 损伤之间的化学反应导致的亲电组蛋白翻译后修饰 (PTM) 的细胞内形成。通常产生的 C4'-氧化无碱基位点 (C4-AP) 是由于提取了相对较弱的碳氢键,该键在小沟中具有高溶剂暴露(方案 1)。
C4-AP 由 各种 DNA 损伤剂,包括抗肿瘤剂,如博莱霉素 (BLM) 和其他氧化损伤 DNA 的药物。这项研究的灵感是发现组蛋白在核小体核心颗粒 (NCP) 的 C4AP 处催化 DNA 切割( 方案 1)。与游离 DNA 相比,链断裂加速了 550 倍,DNA 半衰期短至 15 分钟。此外,负责亲核攻击的赖氨酸的 ε-胺转化为 5-亚甲基-2-吡咯酮 (KMP)。
KMP构成 DNA 损伤诱导的非酶组蛋白 PTM这种修饰改变了赖氨酸上的电荷,例如 N乙酰赖氨酸 (KAc, 结构1),它是调节染色质结构和基因表达的重要 PTM。赖氨酸和赖氨酸上的其他几种非酶 PTMs(也称为非酶共价修饰,NECMs)精氨酸已被报道。这些NECMs由亲电细胞代谢物的反应形成,干扰DNA−组蛋白静电相互作用,并阻止酶放置表观遗传标记。作者团队推断,如果在细胞中形成,KMP的亲电性可能会带来额外的挑战。
Q2 文章亮点
1. 作者团队开发了一种化学蛋白质组学方法来鉴定 HeLa 细胞中的 KMP。每个细胞产生超过 60000 个KMP 修饰的组蛋白。
2. 作者团队发现使用 LC-MS/MS,分布在四种核心组蛋白中的 57 个赖氨酸残基中的 17 个处检测到 KMP。
3. KMP构成了 DNA 损伤诱导的非酶组蛋白翻译后修饰。
4. KMP的形成表明 DNA 损伤导致的下游过程可能对细胞产生影响。
Q3 图文速读
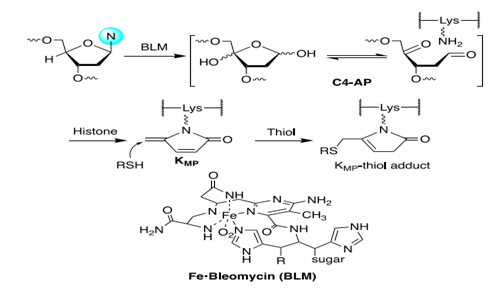
方案 1. C4-AP 生成KMP及其与硫醇的反应
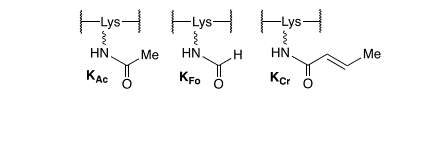
结构 1. N-酰化赖氨酸 PTM 示例
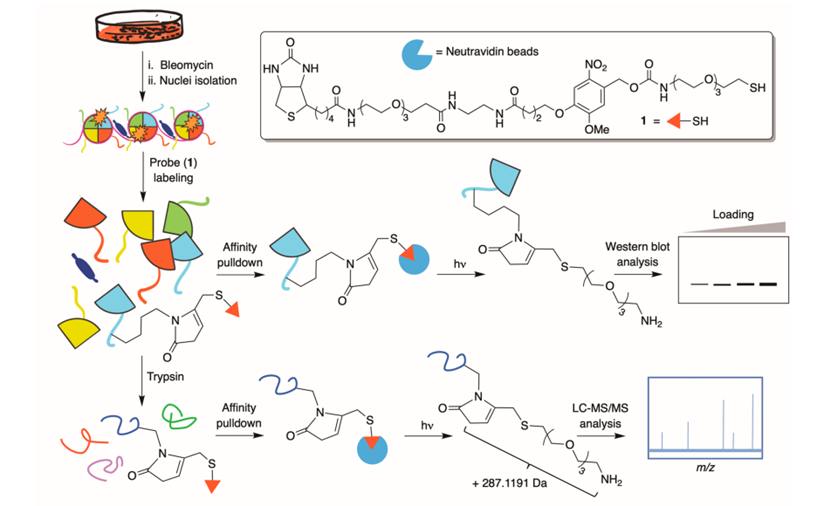
方案 2. 细胞中 KMP 形成的检测
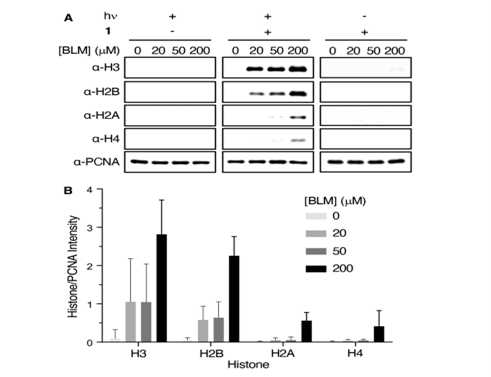
图 1. KMP修饰组蛋白的检测。 (A) 通过蛋白质印迹分析检测。 (B) 组蛋白相对于 PCNA 的带信号强度的量化。条形图中的数据是 3 个生物复制的平均值 ± 标准偏差
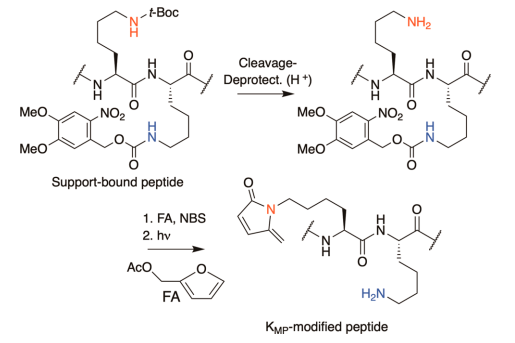
方案 3. 含 KMP 肽的合成策略
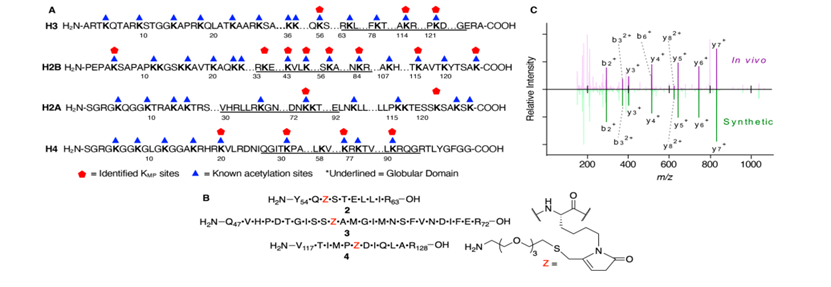
图 2. 通过 LC-MS/MS 鉴定KMP修饰的组蛋白及其与已知 KAc 位点的重叠。 (A) LC-MS/MS 检测到的 KMP位点。 (B) 独立合成的含有KMP的肽。 (C) 从 BLM 处理的 HeLa 细胞获得的染色质中含有 H3K56MP (2, 绿色) 的合成肽 (m/z = 513.2817, z = 3) 和已鉴定的肽 (513.2835, z = 3) 的 MS2 碎片光谱比较 (紫色)

图 3. BLM 诱导的 NCP 中细胞中鉴定的 KMP 位点的接近度和 DNA 损伤。(A) NCP 结构 (PDB: 1KX5) 显示来自处理过的细胞的KMP位点 (彩色球体)。 (B) NCP 中产生的已识别KMP位点和 BLM 损伤位点 (黑色核苷酸) 的叠加 (图 S8)
Q4 总结展望
作者推测,一种不加红皂白的DNA损伤剂会产生更广泛分布的KMP位点。不同于调节染色质结构和遗传表达的组蛋白经颅磁刺激,如KAc,其水平和位置是由酶控制的,KMP是一个NECM。NECMs,如甲基乙二醛诱导的组蛋白精氨酸糖基化,也发挥类似的作用。KMP来源于内源性和外源性产生的亲电DNA损伤(C4-AP),对细胞有害,损害DNA修复(方案1)。
已知少量其他DNA损伤可以共价修饰组蛋白。N7-甲基-2’-脱氧鸟苷与组蛋白赖氨酸可逆反应,在细胞中形成DNA−蛋白交联。另一种C4’-氧化产物,碱丙烯,形成组蛋白的NECMs,但尚未在细胞中报道。同样,有体外证据表明胸腺嘧啶光诱导赖氨酸和精氨酸修饰(pH≥9.5)。虽然内源性甲醛是细胞中KFo的主要来源,DNA损伤3’-甲酰磷酸有助于这种组蛋白修饰的形成。KFo(图1)与N-乙酰赖氨酸(KAc)具有相同的电荷,但不是组蛋白去乙酰化酶的底物。尽管如此,它的存在可能会破坏基因表达的调控。
KMP也具有与KAc相同的电荷,我们假设它也不是组蛋白去乙酰化酶的底物。KMP的亲电性增加了其对细胞过程的潜在影响的额外维度。与共轭的PTMKCr不同(图1)不同,KMP与巯基发生反应,这一特性被用来检测其在细胞中的形成。然而,我们无法通过检测谷胱甘肽化组蛋白(数据未显示)。此外,在鉴定出KMP的17个组蛋白赖氨酸中,有15个与KAc形成的重叠(图2A),这表明该NECM可能对基因表达有广泛的影响。KMP被鉴定的具体例子包括H3K56Ac,它在转录、DNA复制和DNA修复中很重要。
此外,H3K115Ac和H3K122Ac通过RSC和SWI/SNF刺激核小体解体。52H4K77Ac促进DNA解包和转录因子结合。还需要进一步的研究来确定KMP的形成是否具有下游的生物学效应。此外,细胞中KMP的形成提供了确定其他病变是否与组蛋白反应产生细胞中DNA损伤诱导的PTMs提供了动机。正如DNA修复酶的失活一样,组蛋白的NECM支持了这样一种可能性,即最初的化学事件不一定是DNA损伤对细胞造成的后果的唯一来源。
原文链接:https://doi.org/10.1021/jacs.2c02880









暂无评论
发表评论